Variación interanual en las comunidades algales y calidad del agua de una laguna periurbana: Laguna Don Tomás (La Pampa, Argentina).
Interannual variation in algal communities and water quality in a periurban lagoon: Laguna Don Tomás (La Pampa, Argentina).
Manuela Monteyro1*, Andrea Biasotti1, María José Galea1, Ramón Sosa1.
1 Facultad de Ciencias Exactas y Naturales (UNLPam), Santa Rosa, La Pampa, Argentina
Email: manuela.monteyro@gmail.com
Monteyro, M., A. Biasotti, M.J. Galea & R. Sosa. Variación interanual en las comunidades algales y calidad del agua de una laguna periurbana: Laguna Don Tomás (La Pampa, Argentina). Cymbella 11(1): 47-62.
DOI: https://doi.org./10.22201/fc.24488100e.2025.11.1.2
Resumen
Este estudio se realizó en el Parque Recreativo Laguna Don Tomás (Santa Rosa, La Pampa, Argentina) comparando dos períodos comprendidos entre mayo 2019 - febrero 2020 y noviembre 2022 - agosto 2023. Se tomaron muestras en tres puntos de la laguna para evaluar la riqueza ficológica y la calidad del agua a lo largo de las estaciones del año. Se analizaron parámetros físicoquímicos como temperatura, transparencia, pH y conductividad. En el primer período (P1), se identificaron 78 taxones de las clases Chlorophyceae (32), Cyanophyceae (20), Zygnematophyceae (11), Bacillariophyceae (10), Euglenophyceae (4) y Trebouxiophyceae (1). En el segundo período (P2), se registraron 88 taxones, de las Clases Chlorophyceae (39), Cyanophyceae (18), Bacillariophyceae (14), Zygnematophyceae (12), Euglenophyceae (3), Trebouxiophyceae (1) y Dinophyceae (1). Los índices de Nygaard indicaron que la laguna era eutrófica en ambos períodos, con un enriquecimiento de nutrientes en el agua. El índice Plantle & Buck (S=2.52) señaló contaminación orgánica débil (β mesosapróbico) en ambos períodos. El análisis de similitud de las comunidades ficológicas mostró una coincidencia superior al 50 % entre los períodos, y el índice de Jaccard (0.39) reflejó los taxones compartidos entre ambos.
Palabras clave: bioindicador, comunidad algal, impacto antrópico, laguna periurbana.Abstract
This study was conducted at the Laguna Don Tomás Recreational Park (Santa Rosa, La Pampa, Argentina) comparing two periods between May 2019 - February 2020 and November 2022 - August 2023. Samples were taken at three points of the lagoon to evaluate the phycological richness and water quality throughout the seasons. Physicochemical parameters such as temperature, transparency, pH and conductivity were analyzed. In the first period (P1), 78 taxa of the classes Chlorophyceae (32), Cyanophyceae (20), Zygnematophyceae (11), Bacillariophyceae (10), Euglenophyceae (4) and Trebouxiophyceae (1) were identified. In the second period (P2), 88 taxa were recorded, from Classes Chlorophyceae (39), Cyanophyceae (18), Bacillariophyceae (14), Zygnematophyceae (12), Euglenophyceae (3), Trebouxiophyceae (1) and Dinophyceae (1). Nygaard indices indicated that the lagoon was eutrophic in both periods, with nutrient enrichment in the water. The Plantle & Buck index (S=2.52) indicated weak organic pollution (β mesosaprobic) in both periods. Phycological community similarity analysis showed more than 50 % overlap between the periods, and Jaccard’s index (0.39) reflected shared taxa between the two.
Key words: bioindicator, algal community, anthropogenic impact, periurban lagoon.INTRODUCCIÓN
Los lagos urbanos, debido a su menor tamaño en comparación con otros cuerpos de agua, suelen ser someros y, en su mayoría, artificiales e hipertróficos (Quirós 2007). Sin embargo, desempeñan un papel fundamental para los habitantes de la ciudad. Además de ofrecer espacios para actividades recreativas y deportivas, estos ecosistemas contribuyen de manera significativa al bienestar de la comunidad. Entre sus múltiples beneficios se encuentran la reducción de la contaminación, la regulación de variables microclimáticas, la captación de aguas pluviales y residuales, la mejora del ciclo de nutrientes y el refugio para especies que no pueden prosperar en entornos urbanos (Chaves Ramírez 2022).
El manejo ambiental de estos ecosistemas acuáticos es especialmente complejo debido al impacto de las actividades urbanas en sus cuencas de drenaje. Las fuentes de contaminación son tanto puntuales, como el vertido de aguas residuales, desagües pluviales y desechos industriales, como difusas (Chaves Ramírez 2022). Desde la ciudad, llegan a los lagos grandes cantidades de sedimentos, sólidos suspendidos y nutrientes resultantes de la acumulación de sustancias orgánicas e inorgánicas. Esta carga contribuye a la eutrofización de los cuerpos de agua, que deteriora su calidad y altera la composición hidrológica, así como la biodiversidad asociada (Chaves Ramírez 2022; García Miranda & Miranda Rosales 2018; Quirós 2007).
Para evaluar estos cuerpos de agua y el impacto del factor antrópico en su estructura se deben medir variables físicoquímicas y organismos bioindicadores. Estas especies pueden monitorearse con bajo costo, responden fisiológica o conductualmente a una amplia variedad de sustancias clasificándose en intolerantes, facultativas o tolerantes según su nivel de respuesta y tienen la capacidad para colonizar diferentes ambientes que permite su uso para la detección y determinación cualitativa y cuantitativa de contaminantes (Bellinger & Sigee 2010; Coto 2014; Ospina Álvarez & Peña 2004). Algunos ejemplos de bioindicadores son las algas, líquenes, bacterias y protozoos.
En los ambientes acuáticos, la comunidad de algas se utiliza como herramienta de evaluación debido a su sensibilidad a las condiciones ambientales. Factores como la intensidad lumínica, la temperatura, el oxígeno disuelto, el dióxido de carbono y los nutrientes influyen en su composición, siendo el nitrógeno y el fósforo los más relevantes para el fitoplancton (Jin & Pan 2024; Marques & Américo-Pinheiro 2017; Salo & Salovius-Laurén 2022; Suneesh et al. 2022). La sobrecarga de nutrientes proveniente de áreas urbanas puede favorecer a ciertas especies en detrimento de otras, lo que a menudo provoca floraciones algales, que pueden ser perjudiciales tanto para los organismos que habitan en el cuerpo de agua como para las personas que lo utilizan (Borja et al. 2023; Rodríguez-Flórez et al. 2019; Zhang et al. 2021). Además, estudios sobre lagos urbanos, tanto estratificados como no estratificados, han revelado que las poblaciones de Chlorophyceae y Cyanophyceae dominan en estos ecosistemas, lo que puede atribuirse al entorno geográfico de los lagos muestreados (García-Rodríguez et al. 2015; Paul et al. 2012; Zhang et al. 2021).
Las lagunas pampeanas estudiadas son de baja profundidad y se caracterizan por su turbidez, resultado de la alta biomasa algal. Estas lagunas son someras, con salinidad variable y naturalmente eutróficas, muchas de ellas dependientes de las precipitaciones (Quirós 2005). En la mayoría de las lagunas analizadas de la provincia de La Pampa, predomina la clase Chlorophyceae, seguida por Cyanophyceae y Bacillariophyceae, mientras que otras clases, como Euglenophyceae y Dinophyceae, muestran menor diversidad (Álvarez et al. 2000; Álvarez et al. 2005; Bazán et al. 2011; Bazán et al. 2012; Bazán et al. 2014; Novoa et al. 2011). En la laguna Don Tomás se han realizado estudios previos para conocer su fitoplancton (Álvarez 1992; Álvarez & Bazán 1994; Bazán et al. 2003; Neher 2011; Repp 2011) y la estructura de la comunidad del cuerpo de agua (Echaniz & Vignatti 2001; Del Ponti & García 2015; Pilati et al. 2009; Pilati et al. 2020). El objetivo de este trabajo es comparar la riqueza ficológica y la calidad del agua de la laguna Don Tomás durante dos períodos de tiempo.
Materiales y MÉtodos
Área de estudio
La zona de estudio se encuentra comprendida en la provincia biogeográfica Pampeana, particularmente en el distrito del espinal, el cual es caracterizado por la dominancia de especies arbóreas del género Prosopis. Los reservorios de agua subterránea afloran en distintos sitios dando lugar a una gran cantidad de lagunas (Arana et al. 2021). En cuanto a la ictiofauna está conformada principalmente por Odontesthes bonariensis (Del Ponti & García 2015).
La ciudad de Santa Rosa se encuentra en la región oriental de la provincia de La Pampa (Argentina) específicamente en la subregión de colinas y lomas. Su clima es templado, con una temperatura promedio de 24 °C en enero, que puede alcanzar máximas de hasta 45 °C, mientras que en julio la media es de 7.4 °C. La temperatura media anual es de 16 °C, con una humedad relativa promedio del 68 % y una precipitación anual aproximada de 754 mm (SMN 2023). Aledaño a la ciudad se localiza el Parque Recreativo Don Tomás, que alberga una laguna (36°37′11″ S, 64°18′57″ O) originada por una cuenca centrípeta. Esta laguna recibe los desagües pluviales directamente y, hasta 1987, también los desechos cloacales provenientes de los piletones de tratamiento (Del Ponti & García 2015; Pilati et al. 2009). Este lago es somero y permanente con una superficie de 135 hectáreas y una profundidad de 2.3 metros (Echaniz et al. 2008) (Fig. 1).
Trabajo de campo
Variables fisicoquímicas y ambientales
Se registraron in situ las siguientes variables físicoquímicas: pH (sensor Hanna HI 9635), temperatura del agua y del aire (termómetro), y la conductividad (sensor ORION modelo 250 A). Para la determinación de la transparencia del agua se empleó el disco de Secchi de 20 cm de diámetro, con cuadrantes negros y blancos alternados.
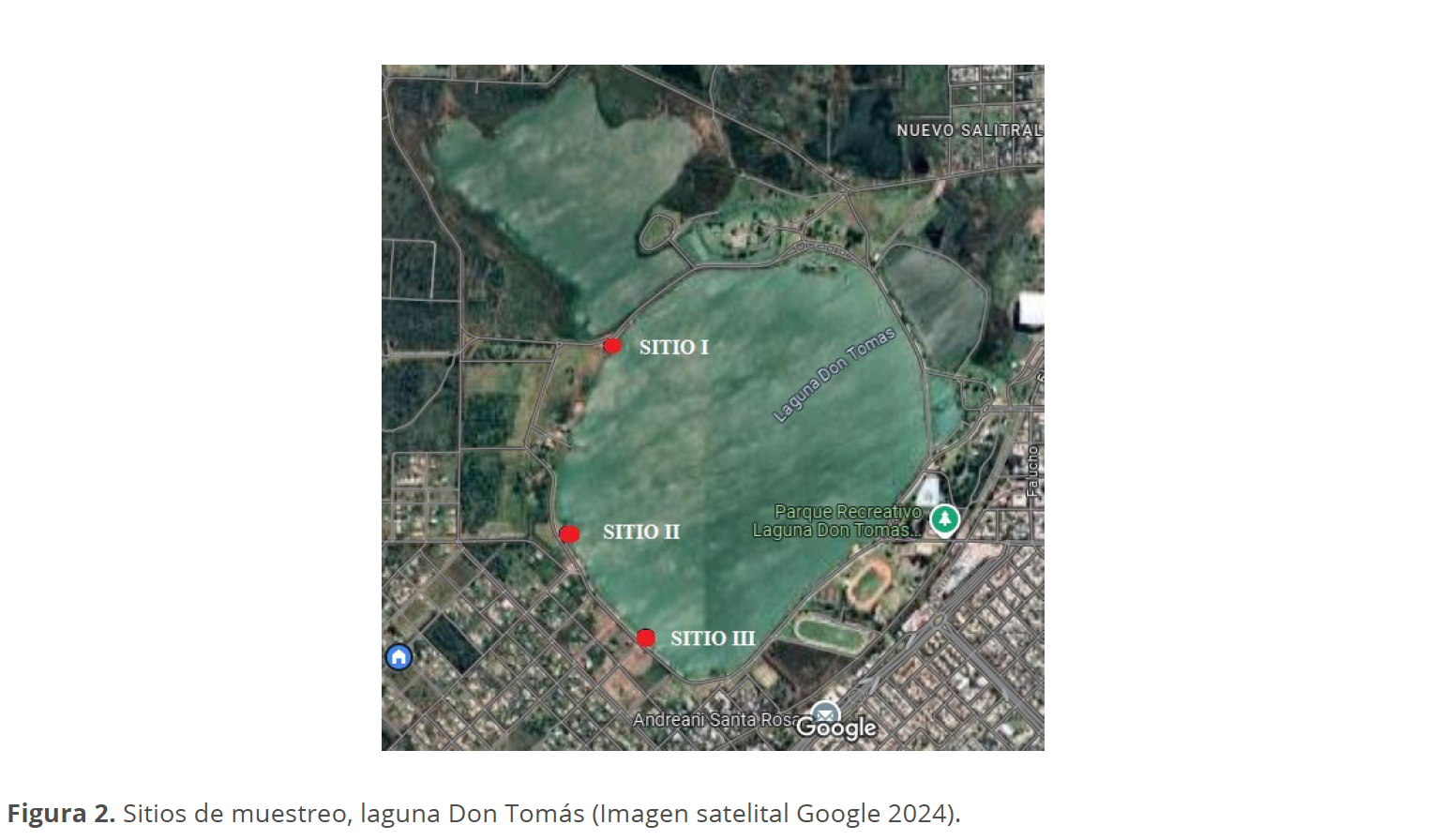
Se colectaron estacionalmente muestras biológicas en el cuenco principal de la Laguna Don Tomás, durante los períodos de mayo 2019 a febrero 2020 (período 1 o, P1) y de noviembre 2022 a agosto 2023 (período 2, o P2). Se establecieron tres sitios de muestreo en función de la accesibilidad a los mismos: el sitio I (36°37’08.6” S, 64°19’10.2” O), sitio II (36°37’29.3” S, 64°19’16.8” O) y el sitio III (36°37’41.7” S, 64°19’05.8”O).
Las muestras ficológicas se colectaron por arrastre manual según técnicas convencionales (Lopretto & Tell 1995; Schwoerbel 1975). Por cada sitio y estación del año se colectaron muestras cualitativas de manera superficial y subsuperficial cerca de la orilla con red de fitoplancton de 25 micras de tamaño de poro, las cuales se unificaron y fijaron con formol 4% (Fig. 2).
Trabajo de Laboratorio
Identificación taxonómica
Las muestras fitoplanctónicas se observaron bajo microscopio óptico Kyowa Medilux 12 con cámara fotográfica en aumentos de 10, 40, 60 y 100x. Para la identificación taxonómica se utilizaron las floras estándar y regionales, así como trabajos específicos de diversos autores (Álvarez 1992; Álvarez & Bazán 1994; Álvarez et al. 2000; Álvarez et al. 2005; Bazán et al. 2003; Bazán 2010; Bazán et al. 2011; Bazán et al. 2012; Bazán et al. 2014; Monteyro 2021; Neher 2011; Novoa et al. 2011). Se consultó la base de datos mundial AlgaeBase, accesible en internet (Guiry & Guiry 2024) para la sinonimia actualizada de las especies.
Tratamiento de los datos taxonómicos
Se confeccionó un listado de las especies identificadas en cada uno de los sitios de muestreo a lo largo de los períodos considerados (P1 y P2).
Se estableció el agrupamiento de las especies registradas en los distintos sitios de muestreo durante el período de estudio mediante el índice de similitud de Bray-Curtis (1957):
Sjk= (b+c) / (2 a+b+c)
Donde:
Sjk: similitud entre sitios j y k.
a: nº de especies comunes entre j y k.
b: nº de especies que están en j, pero no en k.
c: nº de especies que están en k, pero no en j.
Para este cálculo se utilizó el programa BioDiversity Profesional (McAleece et al. 1997)
Se empleó el Coeficiente de Similitud de Jaccard para expresar el grado de cambio de especies entre dos muestreos (Magurran & Magurran 1988). Este coeficiente se obtuvo según la siguiente expresión:
Ij=c/(a+b-j)
donde a = número de especies presentes en el muestreo A, b = número de especies presentes en el muestreo B y j = número de especies presentes en ambos muestreos A y B.
Para los índices de Nygaard (1949) se tuvo en cuenta la riqueza fitoplanctónica de grupos algales para determinar el grado de eutrofización de la laguna Don Tomás para la época muestreada (Roldán Pérez & Ramírez Restrepo 2008). Los índices utilizados fueron de diatomeas y de euglenofitas (Bazán et al. 2018; Mirande & Tracanna 2005; Peña Salamanca et al. 2005; Roldán Pérez & Ramírez Restrepo 2008), los cuales se detallan a continuación:
Índice de Diatomeas = Centrales/ Pennales
Donde:
0-0.2 = oligotrófico
0.2-3 = eutrófico
Índice de Euglenófitas = (Nº taxa euglenofitas) / (Nº taxa cianofíceas + chlorococcales)
Donde:
0.0-1.0 = Eutrófico
0.0-0.7 = Oligotrófico
Para establecer el estado trófico se utilizó la metodología de los saprobios según el índice de Pantle & Buck (Pinilla 2000), que emplea la frecuencia relativa y la valencia sapróbica de cada especie a lo largo del período de muestreo obtenida a través de datos propios y bibliografía existente (Bazán 2010; Biasotti 2016; Olivera 2015; Sládecek 1973):
S = ∑ (s.h) /∑h
S: rango sapróbico
S: valencia sapróbica de la especie
h: frecuencia de la especie (1: escaso, 2: frecuente; 3: muy frecuente)
Donde:
1.0 -1.5 = Ausencia de contaminación
1.5-2.5 = Contaminación orgánica débil
2.5-3.5 = Contaminación orgánica fuerte
3.5-4.0 = Contaminación orgánica muy fuerte
Resultados
Variables físicoquímicas
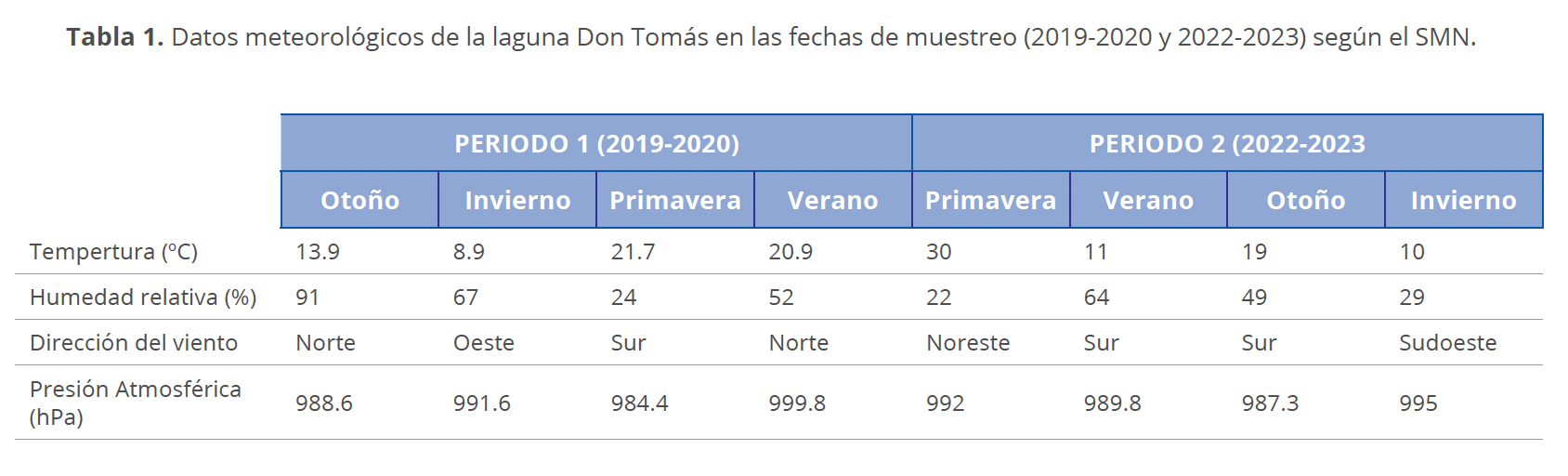
Los datos meteorológicos extraídos del Servicio Meteorológico Nacional (SMN, 2019-2020 y 2022-2023), para las fechas muestreadas se presentan en la Tabla 1.
Las mediciones de temperatura in situ durante los períodos de muestreo oscilaron entre un mínimo de 8.9 °C durante el invierno en el P1, y una temperatura máxima de 30 °C en primavera del P2.
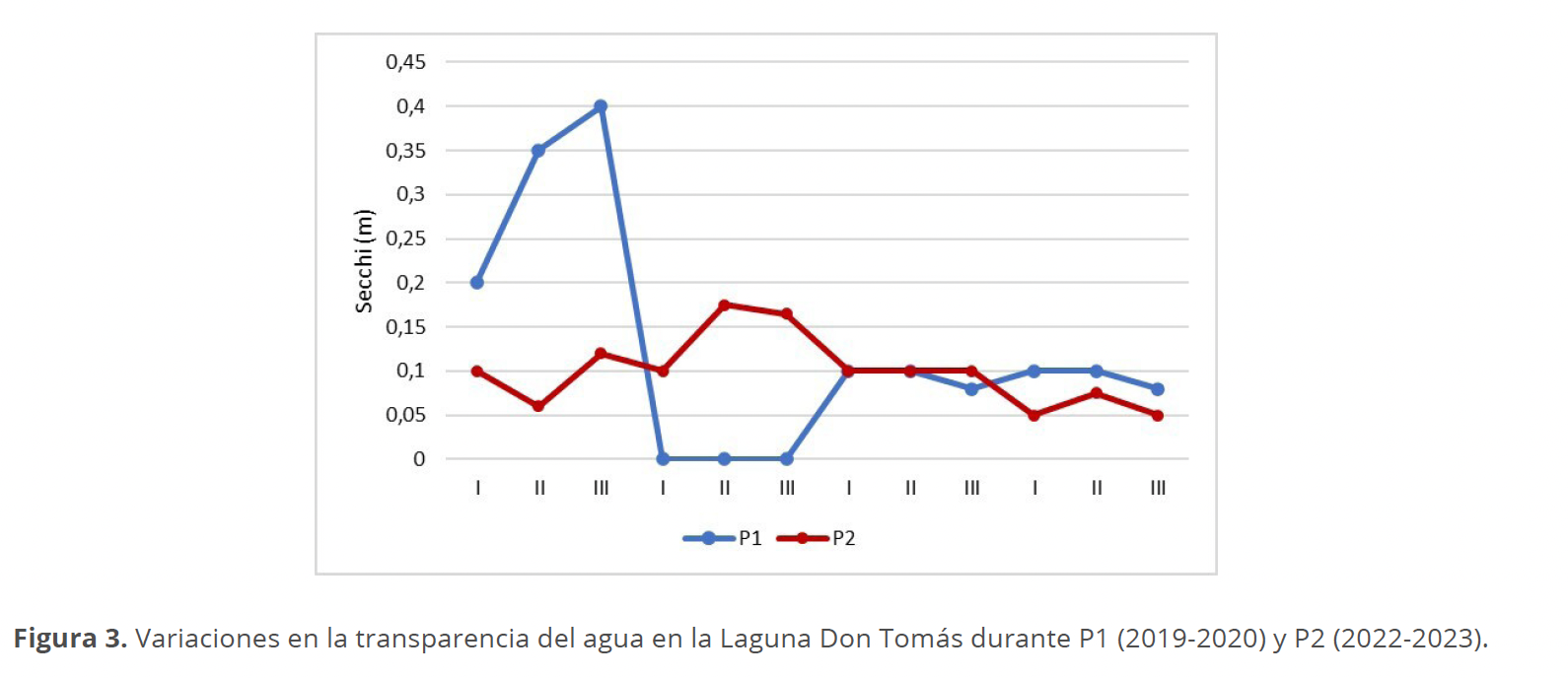
La transparencia obtenida a través del disco de Secchi no registró grandes cambios en los sitios de muestreo en cada estación del año de los períodos muestreados, con valores desde 0 metros (m) para todos los sitios muestreados en el invierno P1 al valor más elevado de 0.4 m en el sitio III en otoño del mismo período (Fig. 3).
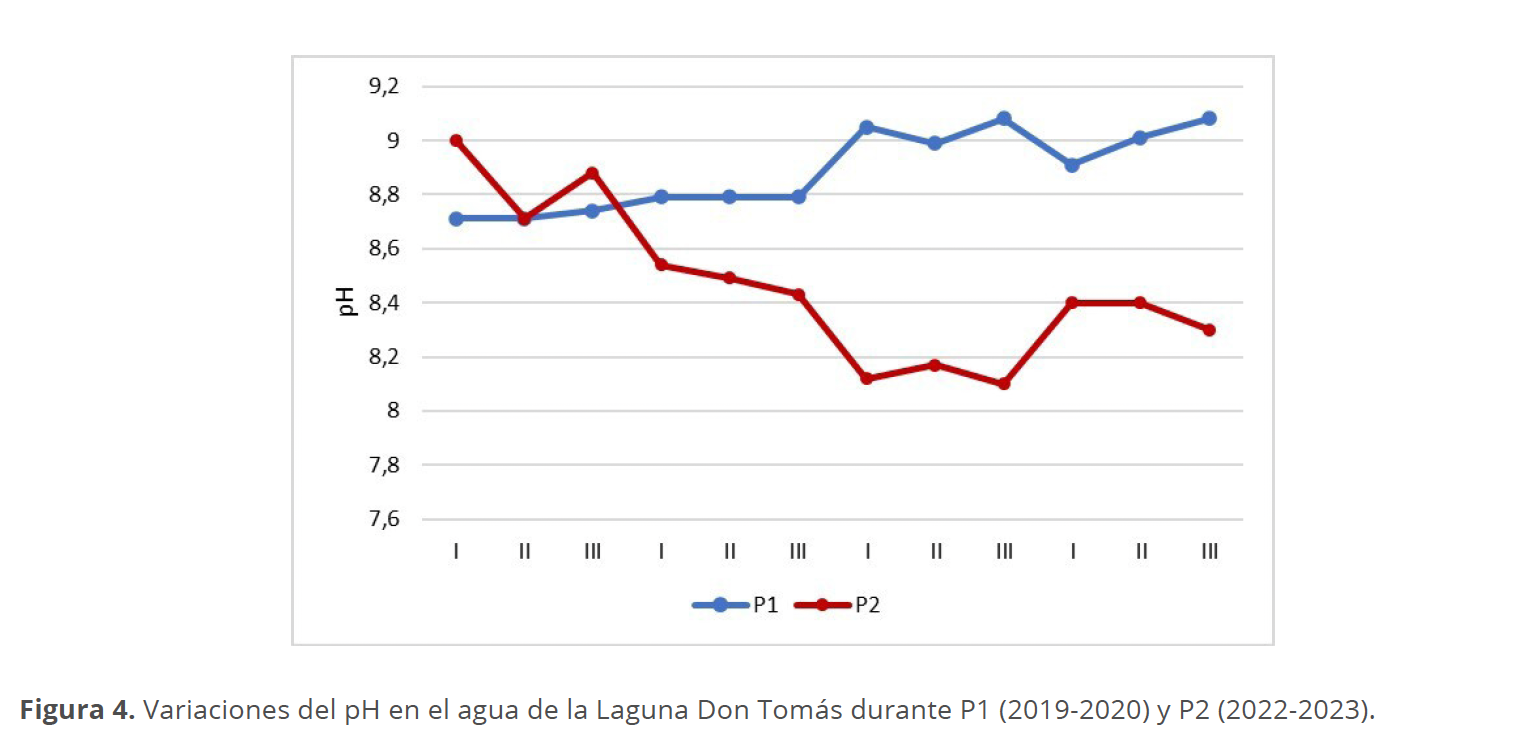
El pH fue alcalino durante los dos períodos muestreados, sin variaciones considerables entre las diferentes estaciones. El rango osciló entre un mínimo de 8.1 para el sitio III en el otoño del P2 y un máximo de 9.08 en el sitio III tanto en la primavera como el verano del P1 (Fig. 4).
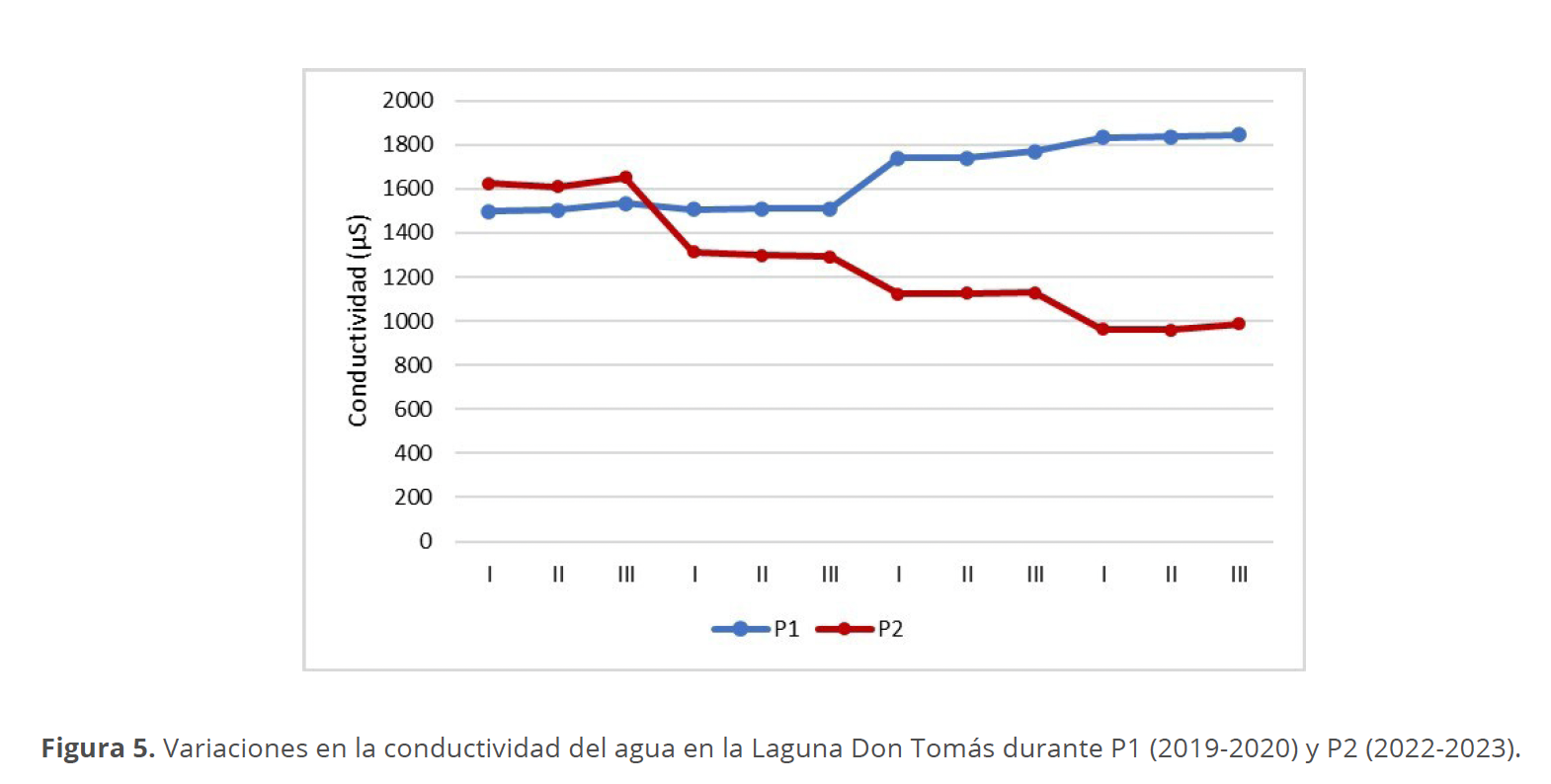
Los valores de conductividad variaron para las distintas estaciones del año de los dos períodos muestreados, con un máximo registrado en el verano de 1845 μS/cm en el sitio III del P1 y un mínimo de 961 μS/cm para el sitio II en el invierno del P2 (Fig. 5).
Resultados del análisis florístico
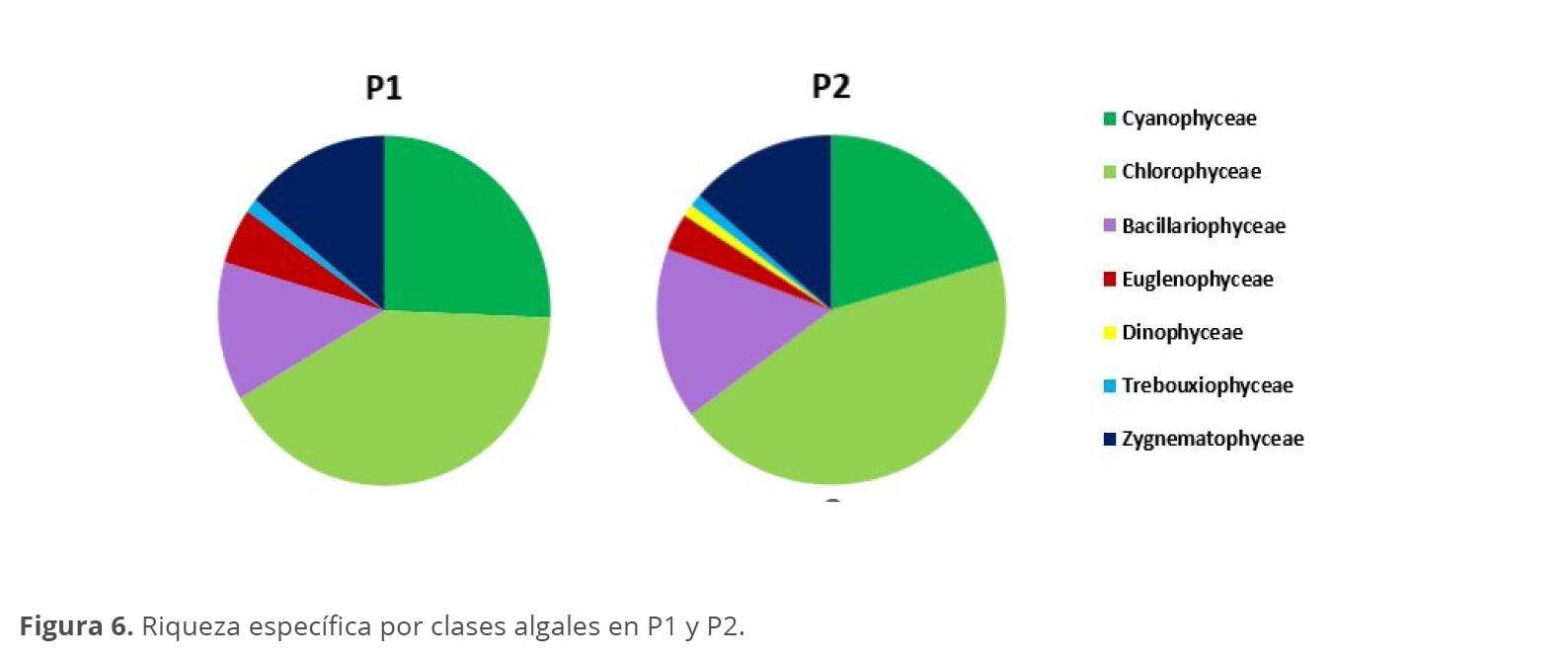
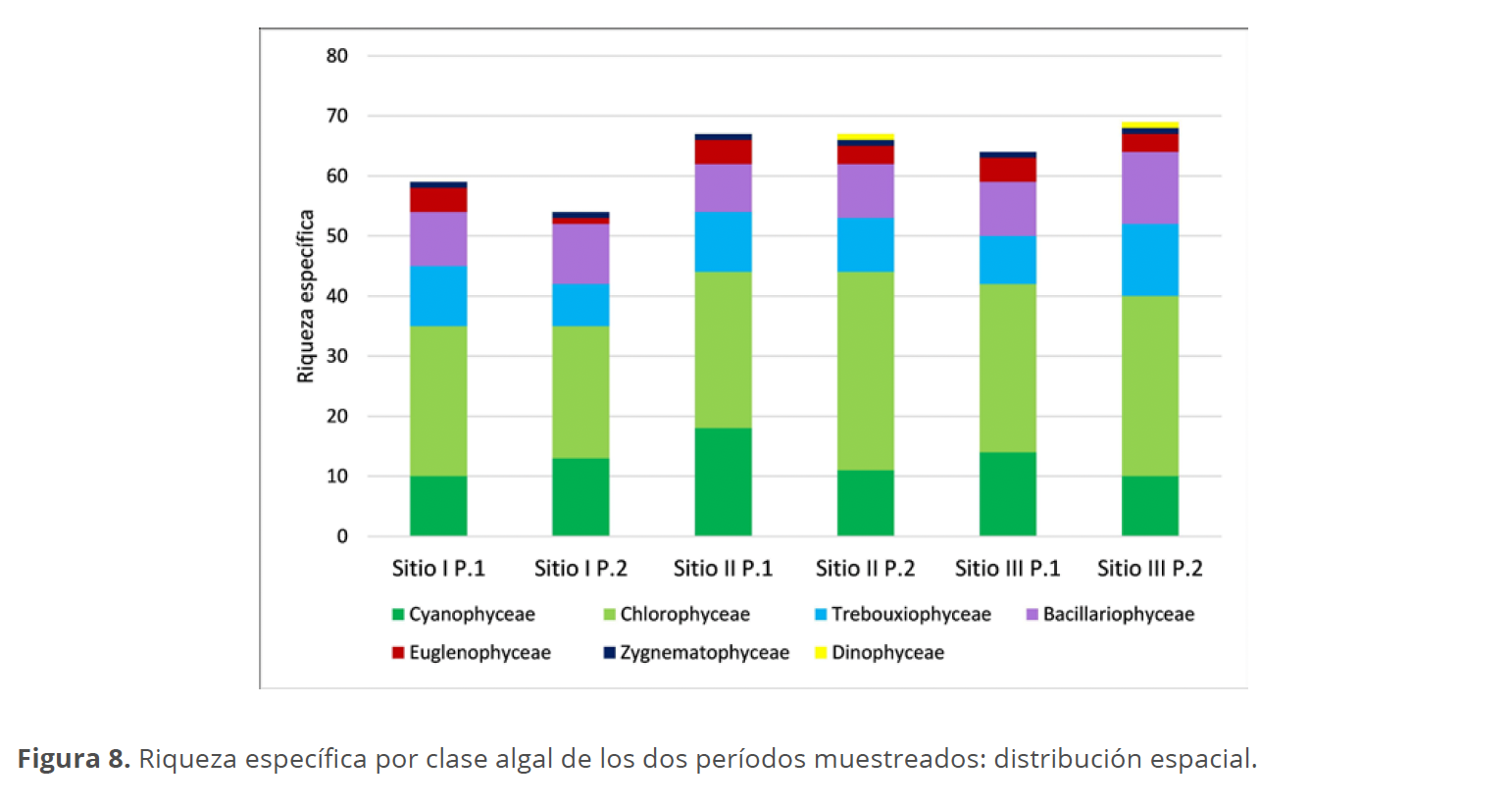
En las muestras colectadas en la laguna Don Tomás en el P1, se determinaron un total de 78 taxones pertenecientes a las Clases Chlorophyceae (32), Cyanophyceae (20), Zygnematophyceae (11), Bacillariophyceae (10), Euglenophyceae (4) y Trebouxiophyceae (1), mientras que en el P2 fueron 88 pertenecientes a las Clases Chlorophyceae (39), Cyanophyceae (18), Bacillariophyceae (14), Zygnematophyceae (12), Euglenophyceae (3) Trebouxiophyceae (1) y Dinophyceae (1) (Tabla 2).
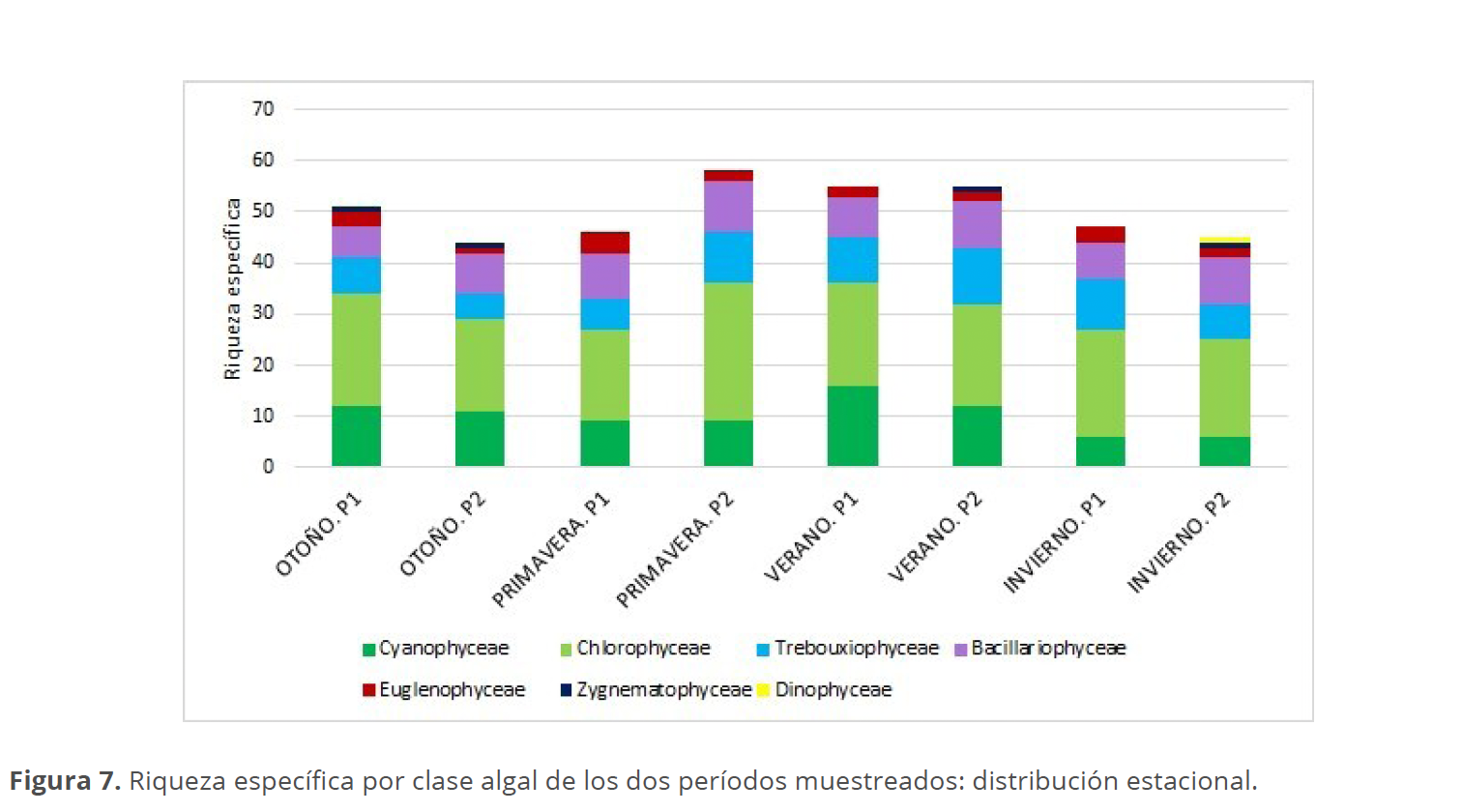
La riqueza específica registró escasa variación entre los diferentes períodos, con mayor número de especies observadas en la primavera del P2 con 58 taxones y el menor durante el otoño del mismo año, con 44 taxones (Fig. 6).
La clase Chlorophyceae presentó el mayor número de taxones en ambos períodos muestreados, con una riqueza similar, independientemente de la estación del año. El número máximo de especies (33) se registró en el sitio II durante el P2, mientras que el mínimo se observó en el sitio I del mismo período. Las Cyanophyceae mostraron una riqueza específica mínima en invierno, tanto en el P1 como en el P2, con solo 6 especies, alcanzando su máximo en el verano del P1 con 16 especies, sin encontrarse diferencias notables entre los sitios muestreados. La clase Trebouxiophyceae exhibió su menor número de representantes en otoño del P2 (5 especies) y el mayor en verano del mismo año (11 especies). Las Bacillariophyceae no presentaron grandes variaciones entre los períodos ni los sitios. En cuanto a las Euglenophyceae, la riqueza específica osciló entre 3 y 4 especies, salvo en el sitio I del P2, donde se observó solo un taxón. La clase Dinophyceae solo se identificó en invierno de 2023, en los sitios II y III. Finalmente, la clase Zygnematophyceae estuvo representada por un único taxón en el otoño de ambos períodos y en el invierno del P2, sin registrar diferencias entre los sitios, los cuales mostraron la misma riqueza específica (Figs. 7 y 8).
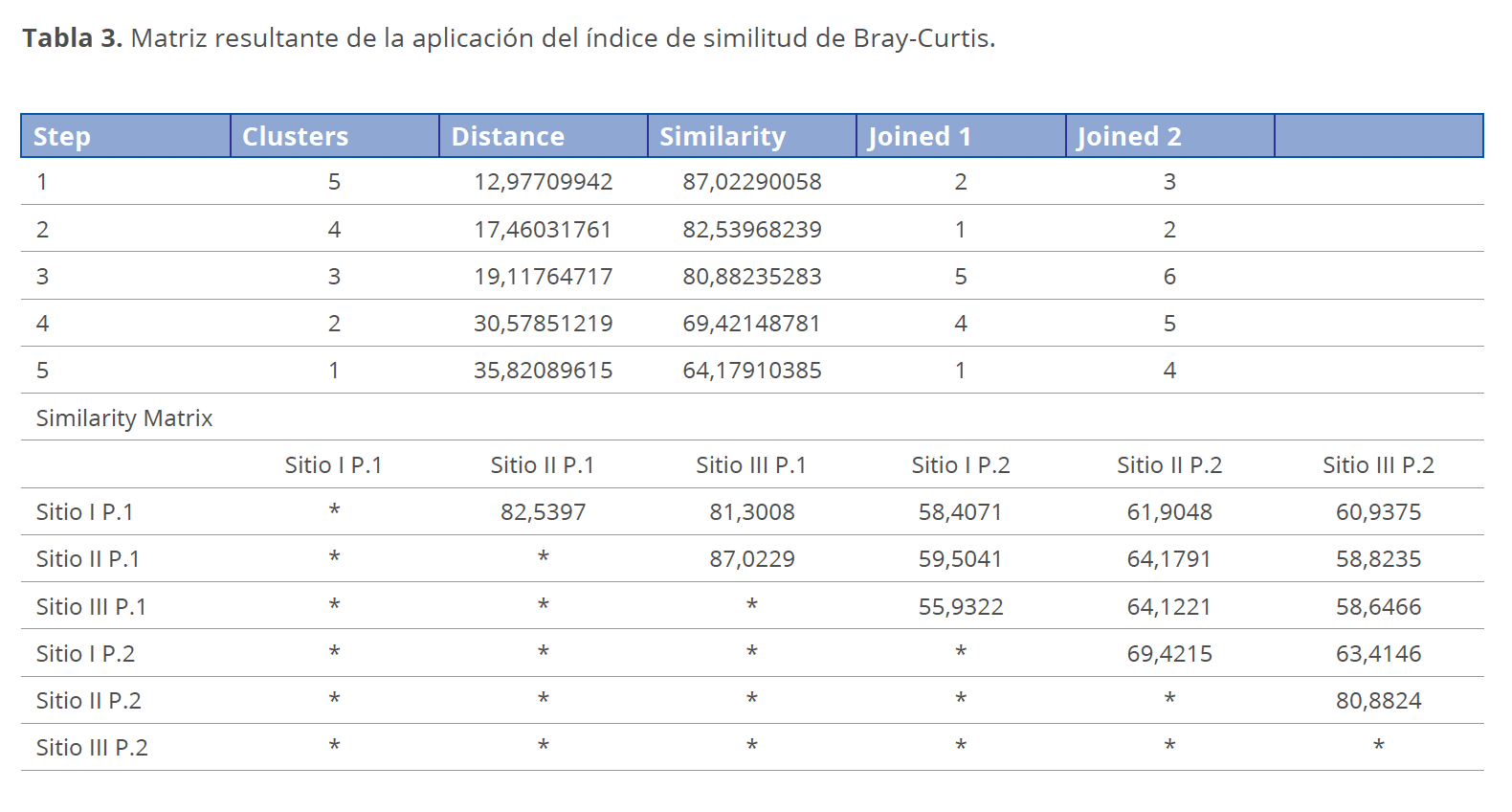
El grado de similitud de la comunidad ficológica de la laguna Don Tomás para los períodos considerados, se evaluó mediante el coeficiente de Bray-Curtis a través de la comparación de los sitios de muestreo con una similitud de más del 50% (Fig. 9, Tabla 3).
El resultado de la aplicación del índice de Nygaard de euglenofitas ubica a la Laguna Don Tomás dentro del rango eutrófico, con una variación mínima de un año a otro, para el P1 fue de 0.13 y para el P2 fue de 0.15. El índice de diatomeas no registró prácticamente diferencia entre el valor del P1 (0.46) y el valor del P2 (0.40) indicando un enriquecimiento de nutrientes en el cuerpo de agua.
Solo las especies Planktothrix agardhii y Tetradesmus lagerheimii se identificaron en todos los sitios muestreados y todas las estaciones del año, tanto del P1 como del P2. El índice de Plantle & Buck calculado para los períodos muestreados registró el mismo valor de S = 2.52, que indicaría una contaminación orgánica débil (β mesosapróbico).
Los taxones compartidos entre los P1 y P2 según el índice de Jaccard es del 0.39. Es decir, se identificaron solo en un período de tiempo, 56 taxones para mayo 2019-febrero 2020 y 32 taxones para noviembre 2022- agosto 2023.
DiscusiÓn y ConclusiÓn
La caracterización físicoquímica del ambiente no mostró grandes variaciones respecto a lo registrado para otros trabajos en la Laguna Don Tomás (Álvarez et al. 2009; Echaniz & Vignatti 2001; Pilati et al. 2009) así como otros cuerpos de agua de la provincia con (Bazán et al. 2012; Vignatti et al. 2024) y sin impacto antrópico (Bazán et al. 2014). La temperatura presentó un patrón de incremento durante la primavera y verano, y de disminución en el invierno, lo cual muestra una relación de este parámetro con las diferentes estaciones del año. La baja transparencia que se observó durante los dos períodos en este cuerpo de agua coincide con otras lagunas de características similares (Bazán et al. 2003; Bazán et al. 2014; Borja et al. 2023; Cony et al. 2014).
Al comparar dos períodos de tiempo con distinto grado de impacto antrópico, se observó un aumento en la riqueza ficológica durante el segundo período (P2), sin que se registraran cambios significativos en la calidad del agua. Las lagunas de la provincia de La Pampa, en general, exhiben una riqueza ficológica dominada por las clorofitas, por encima de otros grupos algales (Bazán et al. 2014). Las algas verdes, reconocidas por su alta tolerancia a distintas condiciones ambientales, son predominantes en los ecosistemas de agua dulce, lo que les permite prosperar en diversos hábitats. De hecho, constituyen el grupo más numeroso del fitoplancton, seguidas por las diatomeas (Huber et al. 2011). En contraposición a otros cuerpos de agua urbanos, en la Laguna Don Tomás las diatomeas ocupan el tercer lugar en términos de abundancia numérica de especies (García-Rodríguez et al. 2015; Novoa et al. 2011).
La clase Chlorophyceae estuvo mayormente representada por organismos del orden Sphaeropleales (Álvarez 1992; Álvarez & Bazán 1994; Bazán et al. 2003; Neher 2011), con predominio de especies de crecimiento rápido y alta tasa de renovación como Scenedesmus, Pediastrum y Kirchneriella, característico e indicativo de un grado de eutrofia moderado a alto (Bazán 2010; Bellinger & Sigee 2010; Kim 2013; Reynolds 2006). Tetradesmus lagerheimii se identificó en todos los sitios muestreados tanto del P1 como del P2, la cual es considerada indicadora de sistemas hipertróficos (García-Rodríguez et al. 2015).
Las especies identificadas de la clase Cyanophyceae son indicadoras de un cuerpo de agua eutrofizado (Bazán et al. 2014; Dantas et al. 2011), con un mayor aporte de organismos del orden Nostocales. Planktothrix agardhii, especie que presenta la capacidad de liberar toxinas (Álvarez et al. 2009; Daga et al. 2020; Kokociński et al. 2010), se encontró durante ambos períodos en todos los sitios muestreados.
En el caso de las diatomeas el orden que tuvo mayor número de representantes fue el de Pennales, propios de un ambiente lenítico (Novoa et al. 2006; Novoa et al. 2011). Se registraron de manera frecuente Aulacoseira granulata, Aulacoseira granulata var. angustissima, Stephanocyclus meneghinianus y Ulnaria ulna, especies cosmopolitas asociadas desde lagos oligotróficos a hipereutróficos (Álvarez-Cobelas & Jacobsen 1992) Stephanocyclus meneghinianus tolera un alto rango de conductividad y es común en ambientes acuáticos con abundante materia orgánica (Daga et al. 2020) y Ulnaria ulna se encuentra entre las más tolerantes a la contaminación severa por nutrientes (Vilches 2012).
Las euglenofitas se encuentran generalmente en entornos donde hay materia orgánica en descomposición, debido a que poseen la capacidad de recoger el material orgánico complejo, ya sea en estado soluble o particulado. Los hábitats típicos incluyen lagos someros, lagunas, humedales, arena salobre, entre otros.
La flora algal observada en la Laguna Don Tomás a lo largo del período de estudio muestra una composición similar a la de otros cuerpos de agua urbanos y lagunas con hipertrofia, tanto de la provincia de La Pampa y sus alrededores (Bazán et al. 2003; Bazán et al. 2012; Bazán et al. 2014; Cony et al. 2014; Vignatti et al. 2024) ya que las mismas clases algales y especies se han identificado tanto en lagunas de la región pampeana como en cuerpos de agua con características ambientales similares (García-Rodríguez et al. 2015; Novoa et al. 2006; Novoa et al. 2011). En la mayoría de las regiones de Argentina, los lagos y lagunas someras se caracterizan por presentar asociaciones florísticas dominadas por Chlorophyceae-Bacillariophyceae o Chlorophyceae-Cyanobacteria (Borja et al. 2023).
La saprobiedad de la Laguna Don Tomás se ubica en el rango mesosapróbico, con valores próximos a los hallados por Bazán et al. (2012) para la Laguna urbana La Arocena ubicada en la ciudad de General Pico (La Pampa), la cual recibe principalmente aportes pluviales de la misma.
Considerando que este ecosistema es utilizado por la población de Santa Rosa y sus alrededores, resulta crucial implementar un monitoreo continuo de los parámetros físicoquímicos y realizar análisis ficológicos periódicos, utilizando estos resultados como información de base. Asimismo, es esencial profundizar en el conocimiento bioecológico de la laguna, a fin de comprender mejor sus fluctuaciones espaciales y temporales y, de esta manera, contribuir a su conservación y gestión sostenible (Dobrescu et al. 2023).
REFERENCIAS
Álvarez-Cobelas, A., & B.A. Jacobsen. 1992. Hypertrophic phytoplankton: an overview. Freshwater Fórum 2: 184-199.
Álvarez, S.B. 1992. Algas de aguas continentales de La Pampa (Argentina) I Volvocales y Chlorococcales. Revista de la Facultad de Agronomía 6: 35-51.
Álvarez, S.B & G.I. Bazán. 1994. Cianofíceas continentales de la provincia de La Pampa (Argentina) I. Revista de la Facultad de Agronomía 7: 43-62.
Álvarez, S.B., G.I. Bazán & M.T. Wenzel. 2000. Hormogonales (Cyanophyta) de la laguna El Guanaco (la pampa, Argentina). Darwiniana 38: 279-284.
Álvarez, S.B., A.E. Biasotti, J.N. Bernardos & G.I. Bazán. 2005. Ficoflora de la laguna Don Tomás (La Pampa, Argentina). Biología Acuática 22: 1-6.
Álvarez, S.B., G.I. Bazán & J.N. Bernardos. 2009. Diversidad fitoplanctónica en los cuencos principal y norte de la laguna Don Tomás (La Pampa. Argentina). Limnetica 28: 0253–0260.
Arana, M.D., E. Natale, N. Ferretti, G. Romano, A. Oggero, G. Martínez, P. Posadas, & J. J. Morrone. 2021. Esquema biogeográfico de la República Argentina. Opera Lilloana, 56.
Bazán, G.I. 2010. Estudios ficológicos en el sistema lenítico de La Arocena (Departamento Maracó), La Pampa, Argentina. Tesis doctoral. Universidad Nacional de Río Cuarto. 203 pp.
Bazán, G.I., S.B. Álvarez, M.C. Martin & J. Bernardos. 2003. Análisis de la taxocenosis de la ficoflora de la Laguna El Ojo de Agua, Uriburu, La Pampa, Argentina. Biología Acuática 20: 1-5.
Bazán, G.I, S.B Álvarez & A.M. de Fabricius. 2011. Microalgas nuevas para Argentina en sistemas leníticos de la provincia de La Pampa. Biológicas Revista de la DES Ciencias Biológico Agropecuarias Universidad Michoacana de San Nicolás de Hidalgo 13: 34-43.
Bazán, G.I, M. Dalmaso, S. Álvarez & A.L.M. Fabricius. 2012. Contribución al conocimiento ficológico y calidad de agua de la laguna La Arocena (pcia. de La Pampa, Argentina). Biología Acuática 27: 17–27.
Bazán, G.I., D. Almeyda, L. Olivera & B. Oriani. 2014. Biodiversidad fitoplanctónica en tres lagunas someras de la Provincia de La Pampa, Argentina. Biología Acuática 30: 47-57.
Bazán, G.I., M.J. Galea & E.A. Biasotti. 2018. Estado trófico de la laguna La Arocena (Pcia. de La Pampa, Argentina): aplicación de índices biológicos. In: VII Congreso Pampeano de Agua: 41-55. Sec. de Rec. Hídricos.
Bellinger, E.G., & D.C. Sigee. 2010. Freshwater Algae: Identification and Use as Bioindicators. Wiley-Blackwell (eds.) 210 pp.
Biasotti, A.E. 2016. Ficoflora de la llanura aluvial del Río Colorado (Patagonia, Argentina). Distribución temporal de la comunidad fitoplanctónica continental. Publicia. ISBN 978-3-8416-8139-3. 156 pp.
Borja, C., F. Dalinger, V. Lozano, C. Muñoz & L. Moraña. 2023. Calidad de agua y fitoplancton del lago del Parque San Martín (Salta, Argentina). Lhawet 9: 35-43.
Bray, J.R., & J.T. Curtis. 1957. An ordination of the upland forest communities of southern Wisconsin. Ecological monographs 27: 326-349.
Chaves Ramírez, C. 2022. Evaluación del estado ambiental del lago en el Parque Metropolitano La Sabana, San José, Costa Rica, para la implementación de medidas de rehabilitación ecológica. Biocenosis 33: 35-42.
Cony, N.L., N. C. Ferrer & E. Cáceres. 2014. Evolución del estado trófico y estructura del fitoplancton de un lago somero de la Región Pampeana: laguna Sauce Grande (provincia de Buenos Aires, Argentina). Biología Acuática 30: 79–91.
Coto, J.G. 2014. Bioindicadores como aliados en el monitoreo de condiciones ambientales. Éxito Empresarial 252: 1-4.
Daga, I.C., M.C. Fernández Belmonte & S. María Reyna. 2020. Composición algal y bioindicadores de calidad de agua. Caso de estudio: Embalse San Roque, Córdoba. Argentina. Cuadernos Del CURIHAM 26: 1–11.
Dantas, Ê.W., A.N. Moura, & M.D.C. Bittencourt-Oliveira. 2011. Cyanobacterial blooms in stratified and destratified eutrophic reservoirs in semi-arid region of Brazil. Anais da Academia Brasileira de Ciências 83: 1327-1338.
Del Ponti, O. & M. García. 2015. Alimentación del pejerrey (Odontesthes bonariensis) en las lagunas Bajo Giuliani y Don Tomás, provincia de La Pampa, Argentina. Semiárida 25: 7–15.
Dobrescu, C. M., A. Turtureanu, & L.M. Dorobat. 2023. Algae as Biological Indicators of Water Pollution. Journal of Danubian Studies and Research 131: 32-38.
Echaniz, S.A. & A.M. Vignatti. 2001. Composición y variación anual de la taxocenosis de cladóceros (Crustácea: Anomopoda y Ctenopoda) planctónicos y química del agua de la laguna Don Tomás (La Pampa, Argentina). Revista de la Facultad de Agronomía 12: 23-35. https://repo.unlpam.edu.ar/handle/unlpam/5998.
Echaniz, S.A., A.M. Vignatti & P.C. Bunino. 2008. El zooplancton de un lago somero hipereutrófico de la región central de Argentina: cambios después de una década. Biota Neotropica 8: 63–71.
García Miranda, F.G. & V. Miranda Rosales. 2018. Eutrofización, una amenaza para el recurso hídrico. In: E. Pérez-Campuzano & V.E. Mota-Flores. Impacto socio-ambiental, territorios sostenibles y desarrollo regional desde el turismo. Universidad Nacional Autónoma de México y Asociación Mexicana de Ciencias para el Desarrollo Regional A.C., Coeditores, México, pp. 353-367.
García-Rodríguez, J., F.I. Molina-Astudillo, E. Miranda-Espinoza, B. Martha & M. Díaz-Vargas. 2015. Variación fitoplanctónica en un lago urbano del municipio de Cuernavaca, Morelos, México. Acta universitaria 25: 3-11.
Guiry, M.D., & G.M. Guiry. 2024. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. https://www.algaebase.org (consultado el 20 de noviembre 2024).
Huber, M.P., M.D. Novoa & A.L. Martínez de Fabricius. 2011. Fitoplancton de una laguna endorreica de uso recreacional (Córdoba, Argentina). Biológicas 13: 24-33.
Jin, C., & Y. Pan. 2024. Application of Algae Biomarkers in Water Quality Monitoring. International Journal of Aquaculture 14: 29–36.
Kim, Y.J. 2013. Taxonomic and Ecological Study of the Families Hydrodictyaceae and Coelastraceae, Order Chlorococcales and Class Chlorophyceae in Korea. Journal of Ecology and Environment 36: 421-437.
Kokociński, M., K. Stefaniak, J. Mankiewicz-Boczek, K. Izydorczyk, & J. Soininen. 2010. The ecology of the invasive cyanobacterium Cylindrospermopsis raciborskii (Nostocales, Cyanophyta) in two hypereutrophic lakes dominated by Planktothrix agardhii (Oscillatoriales, Cyanophyta). European Journal of Phycology 45: 365-374.
Lopretto, E.C. & G. Tell. 1995. Ecosistemas de aguas continentales. Ediciones Sur, La Plata, 3 tomos, 1401 pp.
Magurran, A.E., & A.E. Magurran. 1988. Diversity indices and species abundance models. Ecological diversity and its measurement, 7-45.
Marqués, S.M., & J.H.P. Américo-Pinheiro. 2017. Algas como bioindicadores da qualidade da agua. Revista Científica ANAP Brasil 10: 76-88.
McAleece, N., J.D.G. Gage, P.J.D. Lambshead, & G.L.J. Paterson. 1997. BioDiversity Professional statistics analysis software. Jointly developed by the Scottish Association for Marine Science and the Natural History Museum London.
Mirande, V. & B.C. Tracanna. 2005. Fitoplancton de un río del noroeste argentino contaminado por efluentes azucareros y cloacales. Boletín de la Sociedad Argentina de Botánica 40: 169-182.
Monteyro, M. 2021. Estado trófico y variación espacio-temporal del fitoplancton de una laguna periurbana: laguna Don Tomás (Santa Rosa, La Pampa). Tesis de Licenciatura. Universidad Nacional de la Pampa. https://repo.unlpam.edu.ar/handle/unlpam/9166 (consultado el 20 de noviembre de 2024).
Neher, B.D. 2011. Análisis de la composición algal en relación a los parámetros ambientales durante el verano en la laguna Don Tomás, La Pampa, Argentina. Tesis de Licenciatura. Universidad Nacional de la Pampa. https://repo.unlpam.edu.ar/handle/unlpam/1990 (consultado el 20 de noviembre de 2024).
Novoa, M.D., M.E. Luque, D. Lombardo & A.L. Martínez De Fabricius. 2006. Estudio Ficológico de lagos urbanos artificiales del sur de la provincia de Córdoba. Sociedad Argentina de Botánica 41: 203–231.
Novoa, M., A.L.M. de Fabricius, M.E. Luque & D.M. Lombardo. 2011. Distribución temporal del fitoplancton en un lago urbano del centro de Argentina (Río Cuarto, Córdoba). Biológicas Revista de la DES Ciencias Biológico Agropecuarias Universidad Michoacana de San Nicolás de Hidalgo 13: 1-14.
Nygaard, G. 1949. Hydrobiological studies in some Danish ponds and lakes. Part II. The quotient hypothesis and some new or little known phytoplankton organisms. Det Kongelige Danske Videnskabernes Selskab, Biologiske Skriffer Vol. 7. 293 pp.
Olivera, L. 2015. Estudio de la biodiversidad algal y determinación de calidad de agua y estado trófico en la Laguna Ea. Ansín, Provincia de La Pampa (Argentina). Tesis de Licenciatura. Universidad Nacional de La Pampa. 73 pp.
Ospina Álvarez, N. & E.J. Peña. 2004. Alternativas de Monitoreo de Calidad de Aguas: Algas como Bioindicadores. Acta Nova 2: 513-517.
Paul, W.J., D.P. Hamilton, I. Ostrovsky, S.D. Miller, A. Zhang, & K. Muraoka. 2012. Catchment land use and trophic state impacts on phytoplankton composition: a case study from the Rotorua lakes’ district, New Zealand. Hydrobiologia 698: 133–146.
Peña Salamanca, E.J., M.L. Palacios Peñaranda, N. Ospina-Alvarez. 2005. Algas como indicadoras de contaminación. Universidad del Valle – Programa Editorial.
Pilati, A., S.A. Echaniz, A.M. Vignatti, A. Trucco & S.B. Álvarez. 2009. Efecto del lavado de la ciudad de Santa Rosa sobre el estado trófico de una laguna arreica. Biología acuática 26: 177-184.
Pilati, A., S. Echaniz, A. Vignatti, & G. Bazán. 2020. Dynamics of an autumn phytoplankton bloom in a hypereutrophic urban lake in the semiarid Pampean region (Argentina). Anales de Biología 42: 21-30.
Pinilla, G. 2000. Indicadores biológicos en ecosistemas acuáticos continentales de Colombia. Bogotá: Universidad Jorge Tadeo Lozano, 68 pp.
Quirós, R. 2005. La ecología de las lagunas de las Pampas. Investigación y Ciencia 1: 1-13.
Quirós, R. 2007. Manejo y recuperación de lagos urbanos. Facultad de Agronomía. Universidad de Buenos Aires.
Repp, E.Y. 2011. Biodiversidad algal en relación a los parámetros ambientales durante la primavera en la laguna Don Tomás, La Pampa, Argentina. Tesis de Licenciatura. Universidad Nacional de la Pampa. https://repo.unlpam.edu.ar/handle/unlpam/2022 (consultado el 20 de noviembre 2024).
Reynolds, C.S. 2006. Ecology of Phytoplankton. Cambridge University Press New York. 535 pp.
Rodríguez-Flórez, C.N., A. Vinocur & I. Izaguirre. 2019. Dinámica del fitoplancton en tres lagos urbanos con diferentes estrategias de manejo: Análisis de floraciones estivales. Ecología Austral 29: 072–093.
Roldán Pérez G. & J.J. Ramírez Restrepo. 2008. Fundamentos de Limnología Neotropical .2° Edición. Editorial Universidad de Antioquía. Medellín Colombia. 442 pp.
Salo, T., & S. Salovius-Laurén. 2022. Green algae as bioindicators for long-term nutrient pollution along coastal eutrophication gradient. Ecological Indicators, 140(109034), 109034. https://doi.org/10.1016/j.ecolind.2022.109034.
Schwoerbel, J. & F.J. Aering-Pérez. 1975. Métodos de hidrobiología: biología de agua dulce. H. Blume, Madrid.
Sládecek, V. 1973. System of water quality from the biological point of view. Schweizerbart Science Publishers. Stuttgart, Germany.
Servicio Meteorológico Nacional (SMN). 2019-2020 y 2022-2023. Clima promedio de Santa Rosa, provincia de La Pampa. Recuperado de https://www.smn.gob.ar
Servicio Meteorológico Nacional (SMN). 2023. Estadísticas Climatológicas Normales: República Argentina - Período 1991-2020. SMN, 847 pp.
Suneesh, V.S., W. Longkumer, M. Parmar, & J. Reddy. 2022. Algae used as bio-monitors and bio-remediators. International Journal of Research and Analytical Reviews 9: 340–345.
Rindi, F., H.A. Allali, D.W. Lam, & J.M. Lopez-Bautista. 2010. An overview of the biodiversity and biogeography of terrestrial green algae. In: V. Rescigno & S. Maletta. Eds. Biodiversity Hotspots. Nova Science Publishers, Hauppauge, pp. 105–122.
Vignatti, A., S. Echaniz, A. Biasotti, M. Kin, A. Pilati, G. Cabrera, R. Kihn, F. Cora Jofré, M. Monteyro, M. Savio & V. Giacomino. 2024. Comparación de las características físico químicas y la biota de dos lagunas subsalinas con diferente influencia antrópica del centro de La Pampa (Argentina). In: XII Congreso de Ecología y Manejo de Ecosistemas Acuáticos Pampeanos.
Vilches, C. 2012. Efectos de la contaminación difusa sobre el perifiton de arroyos. Tesis doctoral. Universidad Nacional de La Plata. 172 pp.
Zhang, H., R. Zong, H. He, K. Liu, M. Yan, Y. Miao, B. Ma, & X. Huang. 2021. Biogeographic distribution patterns of algal community in different urban lakes in China: Insights into the dynamics and co-existence. Journal of Environmental Sciences (China) 100: 216–227.
Recibido: 2 de diciembre de 2024
Revisado: 3 de enero de 2025
Corregido: 19 de febrero de 2025
Aceptado: 26 de febrero de 2025

Para ver las tablas descargue el PDF del Artículo aquí