Las macroalgas marinas y el cambio climático.
The marine macroalgae and climate change.
Nataly Quiroz-González1, Julio A. Acosta-Calderón2* y Luz Elena Mateo-Cid3
1Estancia postdoctoral CONACyT. Instituto de Ecología. Universidad del Mar, Campus Puerto Ángel. Ciudad Universitaria s/n, Col. El Faro, C.P. 70902, Puerto Ángel, San Pedro Pochutla, Oaxaca, México.
2Instituto de Ecología. Universidad del Mar, Campus Puerto Ángel. Ciudad Universitaria s/n, Col. El Faro, C.P. 70902, Puerto Ángel, San Pedro Pochutla, Oaxaca, México.
3Laboratorio de Ficología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Prolongación de Carpio y Plan de Ayala, Santo Tomás, Alcaldía Miguel Hidalgo, 11340 CDMX, México.
Corresponding author: email: botanica.umar@gmail.com
Quiroz-González, N., J. Acosta-Caderón & L. E. Mateo-Cid. 2022. Las macroalgas frente el cambio climático. Cymbella 8 (2-3): 53-59.
https://doi.org/10.22201/fc.24488100e.2022.8.2-3.4
Resumen
El cambio climático global está generando afectaciones importantes en los organismos que habitan los ambientes marinos, las macroalgas presentan cambios en su metabolismo, fenología y distribución que se han estudiado con más frecuencia en tiempos recientes debido a la tropicalización de las zonas templadas y polares, cambios en el pH de los océanos y su consecuente acidificación. El presente trabajo ofrece un panorama general del impacto del cambio climático en las macroalgas marinas, así como de algunas de las adaptaciones que estas han desarrollado para su sobrevivencia.
Palabras clave: acidificación, calentamiento global, macroalgas marinas, tropicalizaciónAbstract
Global climate change is generating important effects on the organisms that inhabit marine environments; macroalgae present changes in their metabolism, phenology and distribution that have been studied more frequently in recent times due to the tropicalization of temperate and polar zones, changes in the pH of the oceans and their consequent acidification. This work offers a general overview of the impact of climate change on marine macroalgae, as well as some of the adaptations that they have developed for their survival.
Key words: acidification, global warming, seaweed, tropicalizationEl cambio climático se refiere a los cambios a largo plazo de las temperaturas y los patrones climáticos. Estos cambios pueden ser naturales, debido a variaciones en la actividad solar o erupciones volcánicas grandes. Pero desde el siglo XIX, las actividades humanas han sido el principal motor del cambio climático, debido principalmente a la quema de combustibles fósiles como el carbón, el petróleo y el gas (Thuiller 2007).
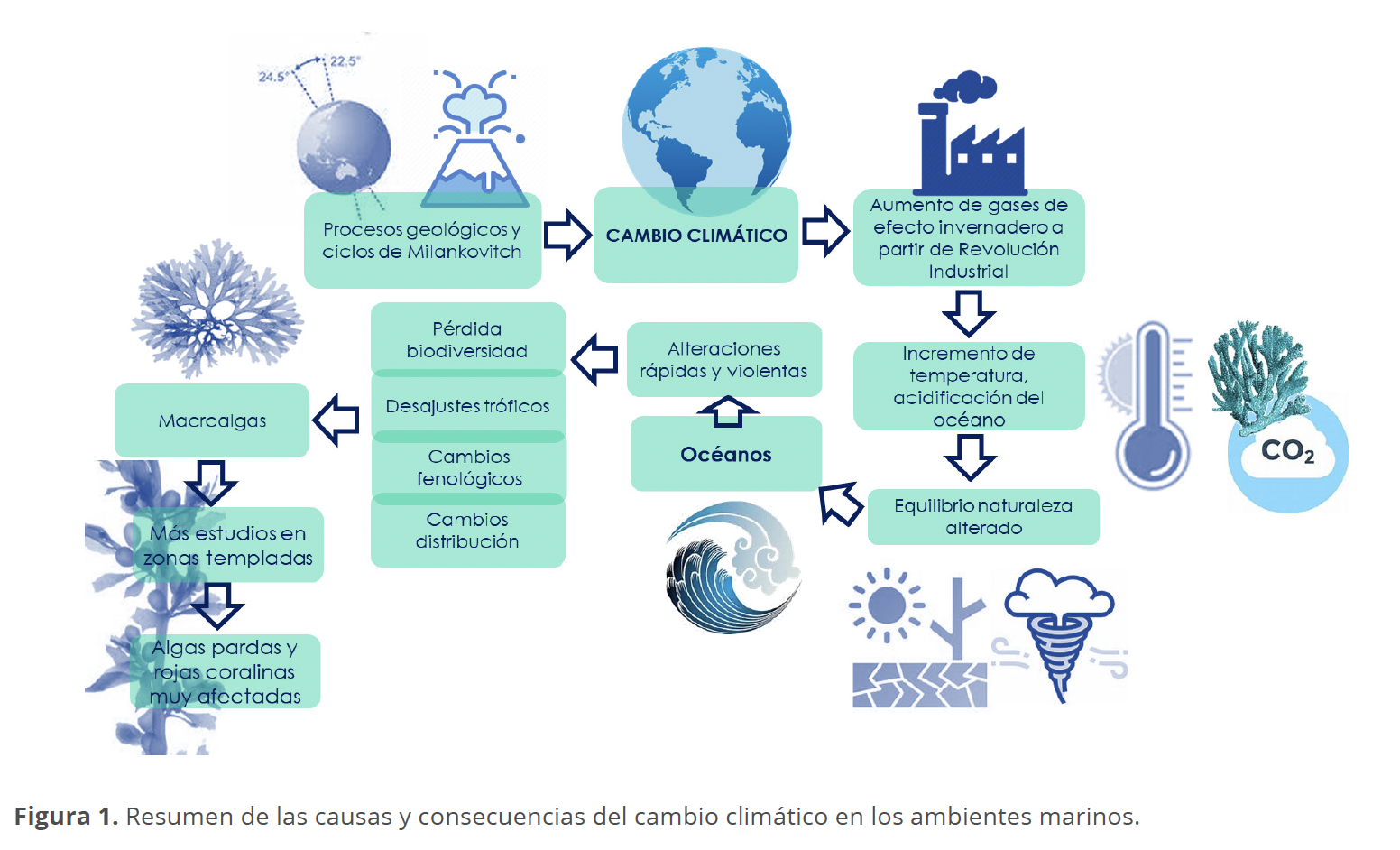
El impacto del cambio climático se ha reflejado en modificaciones en la temperatura del océano, en su biogeoquímica, salinidad, nivel del mar, radiación UV y patrones de circulación de las corrientes marinas (Rilov & Treves 2010). La alteración en los océanos incluye modificaciones a la fenología de los organismos dando como resultado desajustes tróficos entre depredadores y presas, cambios en los límites de distribución de las especies, pérdida de biomasa y de biodiversidad. En este escenario, se espera que las temperaturas medias globales aumenten 2-7 °C a finales del próximo siglo (Ji & Gao 2021) produciendo un aumento de la temperatura superficial del mar. Las preguntas que surgen entonces son: ¿Qué sucederá con los organismos marinos?, ¿Cuáles son los efectos que produce el cambio climático en ellos?, ¿Cómo sobreviven? (Fig. 1).
En los ambientes marinos las respuestas son rápidas y pueden llegar a ser muy severas, especialmente en la zona intermareal donde las especies a menudo viven en sus límites superiores de tolerancia a distintos factores bióticos y abióticos (Benedetti-Cecchi 2001; Christie et al. 2003). Unos de los organismos afectados por los efectos del cambio climático son las macroalgas marinas, cuyo metabolismo y ciclos reproductivos son afectados por factores como la temperatura, la irradiancia, o el pH, a pesar de ello, no representan el grupo más popular al abordar esta problemática, aunque las macroalgas son organismos importantes en los ecosistemas costeros, son productores primarios, proveen de hábitat y alimento para diferentes organismos y poseen una diversidad biológica y metabólica tan amplia como las plantas terrestres por lo que su manera de responder al cambio climático no debe verse como una generalización (Bulleri et al. 2018; Harley et al. 2012; Koch et al. 2013; Largo et al. 2017). Pero, antes de ver los efectos inminentes del cambio climático en las macroalgas es importante indicar que se trata de un grupo de grupos, es decir un conjunto de organismos con diversos orígenes filogenéticos que presentan la capacidad de realizar fotosíntesis y que actúan por lo tanto como estructuradores de las comunidades donde se encuentran, bajo este nombre se incluye a organismos macroscópicos que no forman órganos o estructuras complejas, por lo que se les denomina talofitas, tampoco forman embriones lo que nos permite distinguirlas de plantas simples como los musgos, reconocemos como macroalgas en el presente trabajo a miembros de las divisiones Rhodophyta, Chlorophyta y Heterokontophyta (Lee 2008).
Se tiene evidencia de que el cambio climático afecta distintos aspectos de las macroalgas marinas: el metabolismo estudiado sobre todo a nivel de fotosíntesis o crecimiento, daños a nivel celular, cambios en la morfología de los talos que incluyen reducción en la talla, en los patrones de ramificación y en los casos más drásticos lixiviación del talo, cambios en la fenología, en la distribución latitudinal y vertical, así como modificaciones a la estructura de las comunidades donde se encuentran (Ateweberhan et al. 2005; Davison & Pearson 1996; Eggert 2012; Hernández 1997; Ji & Gao 2021; Monteiro et al. 2022; Rilov & Treves 2010; Tegner & Dayton 1987). En el peor de los casos se espera la extinción de varios cientos de especies de macroalgas (Wernberg et al. 2011). Cabe mencionar que desafortunadamente la gran mayoría de los estudios que evalúan el impacto del cambio climático en las macroalgas se han llevado a cabo con especies de zonas templadas dejando un importante vacío de información en lo que respecta a las especies de zonas tropicales.
IMPACTO DEL INCREMENTO DE TEMPERATURA EN LAS MACROALGAS MARINAS
Las macroalgas poseen adaptaciones a las condiciones locales en las que se desarrollan, sin embargo, existe evidencia de que el aumento de temperatura por encima de sus límites de tolerancia puede reducir su capacidad de respuesta fisiológica a la perturbación (Ji & Gao 2021), lo que genera cambios a nivel fisiológico y morfológico.
La fotosíntesis es uno de los procesos metabólicos más severamente afectados por los aumentos en la temperatura. Existen sitios clave que son alterados como el sistema de fijación de CO2, la fotofosforilación, la cadena de transporte de electrones, y el complejo que desprende oxígeno. El fotosistema II es el primero en ser perturbado por el incremento excesivo de temperatura, se tiene conocimiento de los intervalos óptimos en los que este funciona adecuadamente en distintos grupos algales. Aquellas macroalgas que se desarrollan en el Antártico requieren temperaturas de 10 a 20 °C, seguidas de especies de clima frío a ártico (20 a 25 °C) y finalmente especies de clima templado-cálido a tropical que son quienes toleran las más altas temperaturas (25 a 35 °C) (Eggert 2012).
El estrés por calor también conocido como estrés perturbador puede limitar el crecimiento de macroalgas en las regiones tropicales en verano cuando las altas temperaturas alcanzan el límite superior de tolerancia térmica de estas (Davison & Pearson 1996). Las macroalgas disminuyen fuertemente en biomasa o desaparecen durante la estación cálida (Ateweberhan et al. 2005) de manera más extrema en los ambientes templados. El estrés térmico a corto plazo es más severo para las macroalgas bentónicas en el intermareal alto, donde los factores que causan la desecación y / o las temperaturas críticas determinan el límite de crecimiento (Davison & Pearson 1996). Sin considerar que aquellas con un ciclo de vida heteromórfico a menudo tienen diferentes curvas de respuesta a la temperatura. Este tipo de alteraciones en los talos producidas por el incremento de la temperatura se ha documentado en distintos géneros de macroalgas principalmente de zonas templadas o con interés comercial, dejando un importante vacío de información para especies tropicales o de las cuales no se obtiene un aprovechamiento económico directo.
Por ejemplo, en las rodofitas Gelidium arbuscula y G. canariense se evaluó el impacto del cambio climático en un periodo de 30 años mediante el estudio de la morfología de los talos, dando como resultado que a lo largo de estos años se han generado importantes reducciones de las tallas y modificaciones en los patrones de ramificación, con alteraciones en sus ciclos de vida y disminución de su biomasa (Alfonso et al. 2018). De manera similar en la especie Gelidium robustum se reportan disminuciones de la biomasa, así como blanqueamiento y necrosis de lo talos, en los casos más extremos se presenta lixiviación del talo (Hernández 1997).
Todas las estrategias de adaptación que se presentan a la temperatura implican costos energéticos, así, si las variantes de proteínas/isoenzimas cambian sólo en unos pocos aminoácidos, a un organismo no le cuesta efectivamente más ATP producir una molécula de una variante de lo que cuesta producir otra. Sin embargo, los costos energéticos se vuelven relevantes cuando una proteína en particular se requiere en cantidades mayores o se entrega más rápido. Deben por lo tanto producirse compensaciones con otros procesos metabólicos y cambios en los presupuestos energéticos (Harley et al. 2012).
El estrés oxidativo en las macroalgas es un estado fisiológico generado por el exceso (superávit) de moléculas dentro de las células denominadas especies reactivas de oxígeno o ROS, por sus siglas en inglés (Lu 2006). Las especies reactivas de oxígeno son moléculas que se forman durante los procesos metabólicos de las macroalgas y reaccionan rápidamente con biomoléculas (proteínas y lípidos), modificándolas o destruyéndolas, ocasionando daño celular (Collen 2007). Se ha documentado que el incremento de la temperatura del agua induce la formación de estas moléculas y una forma en las que las macroalgas contrarrestan el estrés oxidativo es mediante la generación de antioxidantes y distintos complejos enzimáticos (Lu 2006). Esto se ha estudiado en especies templadas de importancia económica como Chondrus crispus, Pelvetia canaliculata, Ascophyllum nodosum y Fucus serratus (Collén et al. 2007; Martin et al. 2021).
Otro aspecto esencial en la vida de las macroalgas afectado por el cambio climático son las alteraciones en la fenología de las especies, por lo que se modifican los eventos del ciclo de vida con importantes consecuencias como la asincronía entre las interacciones en los distintos niveles tróficos, el desajuste entre el desarrollo de los organismos y por supuesto la disponibilidad de alimentos, sin señalar cambios como la ausencia de reclutas para las poblaciones. Así, los factores que median la generación de las estructuras de reproducción y su correcto funcionamiento son el fotoperiodo y la temperatura, ambos severamente afectados por el cambio climático (Maggs & Guiry 1987).
La gametogénesis puede ser inducida por días cortos o largos, ya que la calidad espectral y los niveles de irradiancia la controlan, especialmente en ciclos de vida cortos. Es tanta la influencia de la temperatura que se presentan cambios reproductivos respecto a la latitud, por lo que cuando las especies se encuentran en los límites de tolerancia puede presentarse esterilidad (Espinoza-Ávalos 2005). Para las macroalgas, las transiciones de las fases reproductivas incluyen la maduración y liberación de propágulos, esporas y / o gametos, estos procesos son mediados por la temperatura al menos en un 75% de las macroalgas marinas que se han estudiado (Lobban & Harrison 1994), los cuales en gran medida se han estudiado en macroalgas pardas del orden Laminariales, así como pocos órdenes de macroalgas rojas como Ceramiales, Bonnemaisoniales y Gigartinales, (de Bettignies et al. 2018) resaltando nuevamente la problemática en lo que se refiere a la ausencia de estudios en especies tropicales. Por ejemplo, para Macrocystis pyrifera se sabe que el aumento de temperatura tiene efectos negativos sobre la producción de esporas, la germinación, el reclutamiento y el desarrollo de los esporofitos (Buschmann et al. 2004).
Para la mayoría de las especies de Rhodophyta, tanto la gametogénesis como la esporogénesis son controladas por una combinación única de temperatura y duración del día que resulta en una ventana reproductiva estricta (de Bettignies et al. 2018). Así las macroalgas rojas templadas no logran reproducirse, o su respuesta reproductiva es mucho más baja fuera de los requisitos fotoperiódicos y de temperatura específicos (de Bettignies et al. 2018).
La temperatura también influye en la distribución de las macroalgas, actualmente existe un cambio global, las especies templadas se han desplazado hacia los polos en respuesta al aumento de las temperaturas, lo que representa un fenómeno contemporáneo bien documentado durante la última década. Por ejemplo, las macroalgas templadas australianas retrocedieron 2° de latitud hacia el polo durante el último medio siglo (Wernberg et al. 2011). Tales cambios pueden tener un impacto profundo en las comunidades de las zonas intermareales. En otros casos, como en la Península Ibérica se han detectado cambios en la biomasa de poblaciones algales correlacionadas con el incremento paulatino de la temperatura de la superficie del agua en los últimos 10 años (Monteiro et al. 2022; Piñeiro-Corbeira et al. 2018).
Los incrementos de temperatura además han beneficiado el desplazamiento de especies con potencial para convertirse en invasoras, ya que puede favorecer a macroalgas marinas oportunistas y tolerantes que aumentan su capacidad competitiva, propiciando el reemplazo de especies menos tolerantes, cambiando drásticamente la composición de los sitios (Dukes 2007; Monteiro et al. 2022; Piñeiro-Corbeira et al. 2018), algo que en muchos casos ha derivado de la fácil transferencia que están teniendo muchas especies cultivables desde zonas tropicales a templadas donde bajo otro escenario hubiera sido prácticamente imposible explotarlas de esta forma, ejemplos de esto se presenta en los géneros Kappaphycus y Eucheuma (Largo et al. 2017).
Se ha registrado el impacto del cambio climático en los bosques y praderas de macroalgas que forman las zonas intermareales en regiones templadas, causando daños importantes al resto de la red trófica, ya que estas participan de manera esencial como estructuradoras de las comunidades donde se desarrollan, su pérdida afecta la superficie habitable, la disponibilidad de alimento, reduce las zonas para asentamiento, disminuye el reclutamiento, la protección contra las olas, la desecación y contra gran cantidad de depredadores (Hargrave et al. 2016; Jueterbock et al. 2013).
Otro aspecto que se ve notablemente afectado por el incremento de la temperatura es el aumento de los herbívoros, lo que puede desencadenar, en casos muy drásticos, la desaparición de bosques y praderas de macroalgas completos. Por ejemplo, en el sur de Japón se ha registrado la desaparición de Ecklonia cava y Sargassum debido al pastoreo de peces herbívoros de aguas cálidas (por ejemplo, peces loro) que han invadido la zona (Largo et al. 2017) trayendo además como una consecuencia directa que estos hábitats desocupados puedan ser colonizados por otras macroalgas de sitios tropicales más resistentes a los herbívoros, modificando de este modo la composición de la comunidad.
Se ha indicado que, en condiciones de estrés por modificaciones en los factores ambientales, como la temperatura, las macroalgas reducen la producción de sustancias de defensa contra herbívoros como los florotaninos tal como se ha registrado en Fucus vesiculosus y aumenta por lo tanto su susceptibilidad a los depredadores (Kinnby et al. 2021).
La notable pérdida de macroalgas marinas y las modificaciones en las comunidades donde se desarrollan se han acompañado de la aparición de especies oportunistas que generan incrementos desmesurados en sus poblaciones lo que deriva en las denominadas mareas marrones, verdes y el aumento de los céspedes algales. Especies de Asparagopsis, Gracilaria, Sargassum, Caulerpa, Ulva y Undaria son algunos de los ejemplos de macroalgas conocidas por ser invasoras prolíficas con una importante capacidad de alterar procesos ecológicos. Ejemplo de esto se ha observado en las recientes mareas masivas de las especies de Sargassum en el Caribe que han repercutido a escala biológica, ecológica y económica y en las mareas verdes producidas por Ulva en China cuyos impactos han sido más intensos desde 2008 (Klinger 2021). En el caso particular de Sargassum una de las explicaciones que se ha dado para sus arribazones masivas se vincula directamente con el cambio climático el cual ha modificado la dinámica de estas poblaciones, así como sus patrones de distribución, se presume que el incremento de la temperatura superficial del mar podría haber obligado al Mar de los Sargazos a desplazarse más hacia el sur, acercando las algas al Mar Caribe, claramente es un problema que no podrá solucionarse a corto o mediano plazo, que requiere estrategias para la mitigación del daño y que representa un desafió para las comunidades afectadas (Louime et al. 2017).
EFECTO DE LA ACIDIFICACIÓN DE LOS OCÉANOS EN LAS MACROALGAS MARINAS
Otro aspecto que se ha visto radicalmente afectado por el cambio climático es el pH de los océanos, por lo que la acidificación es un problema derivado que daña a muchos grupos de macroalgas incluyendo a algunas estructuradoras de comunidades muy importantes como los arrecifes de coral. Las macroalgas que incrustan carbonato de calcio en sus talos provienen de orígenes filogenéticos muy diversos y se encuentran en diferentes latitudes. Es el caso de las macroalgas rojas Corallinalles y Nemaliales, de algunas macroalgas verdes de los órdenes Bryopsidales y Dasycladales como Halimeda, Penicillus, Udotea a las que se les denomina en conjunto macroalgas AVC (macroalgas verdes calcáreas), todas ellas constituyen los principales productores biogénicos de CO2 al que también se le ha denominado carbono azul (Koch et al. 2013; Ortegón-Aznar et al. 2016).
La acidificación afecta directamente la tasa fotosintética y calcificación de las macroalgas que fijan carbonato de calcio (macroalgas calcáreas), así como a las macroalgas que no lo hacen (Cao & Caldeira 2008; Roleda & Hurd 2012). Por ejemplo, Ogata & Matsui (1965) determinaron el efecto de los cambios en el pH respecto a la fotosíntesis para Gelidium amansii en Japón, señalando que el máximo de la tasa fotosintética se encuentra a 7.7 de pH y que por debajo de este valor se presentan afectaciones. Semesi et al. (2009) demostraron que un incremento de CO2 disuelto en el agua disminuyó la calcificación de rodolitos del género Hydrolithon. Rilov & Treves (2010) indicaron que la acidificación del océano puede provocar la desaparición del 10 al 40% de estas especies. Específicamente para el ambiente marino, los cambios globales incluirán un aumento de dióxido de carbono que acidificará los medios acuosos, se ha estimado que, para el CO2, el cambio podría ser de los actuales 350 ppm a aproximadamente 750 ppm dentro de los 50 años, aproximadamente (Eggert 2012).
CONSIDERACIONES FINALES
Es evidente que el cambio climático global afecta notablemente a la biología y fisiología de las macroalgas marinas a una velocidad mayor que lo que puede detectarse en ambientes terrestres con otros organismos, por lo que es necesario realizar estudios que den cuenta del efecto de los incrementos de temperatura y de la acidificación de los océanos sobre todo en aquellas especies de macroalgas que se desarrollan en zonas tropicales donde los estudios son escasos, ya que desconocemos el verdadero alcance del cambio climático en estos organismos. Es indispensable llevar a cabo un monitoreo de diversas poblaciones de macroalgas para reconocer su comportamiento y cambios a lo largo del tiempo, a la vez de llevar a cabo revisiones en sus caracteres morfológicos, en sus características químicas e incluso en sus interacciones ecológicas sólo así se podrá establecer el impacto del cambio climático en las poblaciones de macroalgas tropicales especialmente en México donde existen una multitud de ambientes con condiciones muy particulares.
REFERENCIAS
Alfonso, B., J. Hernández, & M. Sansón. 2018. Tetraspore germination of two vulnerable marine algae, Gelidium canariense and G. arbusculum (Rhodophyta, Gelidiales). Botanica Marina 61: 111-114. DOI: https://doi.org/10.1515/bot-2017-0126
Ateweberhan, M., J. Bruggemann, & A. Breeman. 2005. Seasonal patterns of biomass, growth and reproduction in Dictyota cervicornis and Stoechospermum polyplioides (Dictyotales, Phaeophyta) on a shallow reef flat in the southern Red Sea (Eritrea). Botanica Marina 48: 8-17. DOI: https://doi.org/10.1515/BOT.2005.001
Benedetti-Cecchi, L. 2001. Variability in abundance of algae and invertebrates at different spatial scales on rocky seashores. Marine Ecology Progress Series (215): 79-92. DOI: https://doi.org/10.3354/meps215079
Bulleri, F., B.K. Eriksson, A. Queirós, L. Airoldi, F. Arenas, C. Arvanitidis, T.J. Bouma, T.P. Crowe, D. Davoult, K. Guizien, L. Iveša, S.R. Jenkins, R. Michalet, C. Olabarria, G. Procaccini, E.A. Serrão, M. Wahl, & L. Benedetti-Cecchi. 2018. Harnessing positive species interactions as a tool against climate- driven loss of coastal biodiversity. PloS Biology 16: e2006852. DOI: https://doi.org/10.1371/journal.pbio.2006852
Buschmann, A.H., J. Vázquez, P. Osorio, E. Reyes, L. Filun, M.C. Hernández-González, & A. Vega. 2004. The effect of water movement, temperature and salinity on abundance and reproductive patterns of Macrocystis spp. (Phaeophyta) at different latitudes in Chile. Marine Biology 145: 849-62. DOI: https://doi.org/10.1007/s00227-004-1393-8
Cao, L. & K. Caldeira. 2008. Atmospheric CO2 stabilization and ocean acidification. Geophysical Research Letters 35, L19609. DOI: https://doi.org/10.1029/2008GL035072
Christie, H., N.M. Jørgensen, K.M. Norderhaug, & E. Waage-Nielsen. 2003. Species distribution and habitat exploitation of fauna associated with kelp (Laminaria hyperborea) along the Norwegian coast. Journal of the Marine Biological Association of the United Kingdom: 83: 687–699. DOI: https://doi.org/10.1017/S0025315403007653h
Collén, J., I. Guisle-Marsollier, J.J. Léger, & C. Boyen. 2007. Response of the transcriptome of the intertidal red seaweed Chondrus crispus to controlled and natural stresses. New Phytologist 176: 45-55. DOI: https://doi.org/10.1111/j.1469-8137.2007.02152.x
Davison, I. & G. Pearson. 1996. Stress tolerance in intertidal seaweeds. Journal of Phycology 32: 197-211. DOI: https://doi.org/10.1111/j.0022-3646.1996.00197.x
de Bettignies, T., T. Wernberg, & C.F.D. Gurgel. 2018. Exploring the Influence of Temperature on Aspects of the Reproductive Phenology of Temperate Seaweeds. Frontiers in Marine Science 5: 218. DOI: https://doi.org/10.3389/fmars.2018.00218
Dukes, J.R. 2007. Tomorrows plant communities: different, but how? New Phytologist 176: 235-237. DOI: https://doi.org/10.1111/j.1469-8137.2007.02224.x
Eggert, A. 2012. Seaweed Responses to Temperature. In: C. Wiencke & K. Bischof. Eds. Seaweed Biology. Ecological Studies. 219 p. DOI: https://doi.org/10.1007/978-3-642-28451-9_3
Espinoza-Avalos, J. 2005. Fenología de macroalgas marinas. Hidrobiológica 15: 109-122. Accesible en: https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0188-88972005000100010
Hargrave, M.S., A. Foggo, A. Pessarrodona, & D.A. Smale. 2016. The effects of warming on the ecophysiology of two co-existing kelp species with contrasting distributions. Oecologia 183: 1-13. DOI: https://doi.org/10.1007/s00442-016-3776-1
Harley, C.D., K. M. Anderson, K.W. Demes, J. P. Jorve, R.L. Kordas, T.A. Coyle, & M.H. Graham. 2012. Effects of climate change on global seaweed communities. Journal of Phycology 48: 1064-78. DOI: https://doi.org/10.1111/j.1529-8817.2012.01224.x
Hernández, C. 1997. Análisis de la variación estacional e interanual de la cosecha de Gelidium robustum en Baja California Sur, México. Tesis de maestría. Centro Interdisciplinario de Ciencias Marinas. México. 60 p.
Ji, Y. & K. Gao. 2021. Effects of climate change factors on marine macroalgae: A review. Advances in marine biology 88: 91-136. DOI: https://doi.org/10.1016/bs.amb.2020.11.001
Jueterbock, A., L. Tyberghein, H. Verbruggen, J.A. Coyer, J.L. Olsen, & G. Hoarau. 2013. Climate change impact on seaweed meadow distribution in the North Atlantic rocky intertidal. Ecology and evolution 3: 1356-1373. DOI: https://doi.org/10.1002/ece3.541
Kinnby, A.G., B. Toth, & H. Pavia. 2021. Climate Change Increases Susceptibility to Grazers in a Foundation Seaweed. Frontiers of Marine Science 8: 688406. DOI: https://doi.org/10.3389/fmars.2021.688406
Klinger, T. 2021. Optimizing seaweed futures under climate change. Botanica Marina 64: 439-443. DOI: https://doi.org/10.1515/bot-2021-0036
Koch, M., G. Bowes, C. Ross, & X.H. Zhang. 2013. Climate change and ocean acidification effects on seagrasses and marine macroalgae. Global Change Biology 19: 103-132. DOI: https://doi.org/10.1111/j.1365-2486.2012.02791.x
Largo, D., I. Chung, S. Phang, G. Gerung, & C. Sondak. 2017. Impacts of Climate change on Eucheuma-Kappaphycus Farming. In A.Q. Hurtado, A. Critchley, & I. Neish. Eds. Tropical Seaweed Farming Trends, Problems and Opportunities, Developments in Applied Phycology 9: 121-129. DOI:10.1007/978-3-319-63498-2_7
Lobban, C.S. & P.J. Harrison. 1994. Seaweed ecology and physiology. Cambridge University Press, New York.
Louime, C., J. Fortune, & G. Gervais. 2017. Sargassum Invasion of Coastal Environments: A Growing Concern. American Journal of Environmental Sciences 13: 58-64. DOI: https://doi.org/10.3844/ajessp.2017.58.64
Lu, C., S. Guanqun, & L. Jin-Ming. 2006. Reactive oxygen species and their chemiluminescence-detection methods. TrAC Trends in Analytical Chemistry 25: 985-995. DOI: https://doi.org/10.1016/j.trac.2006.07.007
Maggs C.A. & M.D. Guiry. 1987. Gelidiella calcicola sp. nov (Rhodophyta) from the British Isles and Northern France. European Journal of Phycology 22: 417-434. DOI: https://doi.org/10.1080/00071618700650481
Martin, M.A., O.A. Sendra, A. Bastos, N. Bauer, C. Bertram, T. Blenckner, K. Bowen, P.M. Brando, T.B. Rudolph, M. Büchs, M. Bustamante, D. Chen, H. Cleugh, P. Dasgupta, F. Denton, J.F. Donges, F.K. Donkor, H. Duan, C.M. Duarte, K.L. Ebi, C.M. Edwards, A. Engel, E. Fisher, S. Fuss, J. Gaertner, A. Gettelman, C.A.J. Girardin, N.R. Golledge, J.F. Green, M.R. Grose, M. Hashizume, S. Hebden, H. Hepach, M. Hirota, H.-H. Hsu, S. Kojima, S. Lele, S. Lorek, H.K. Lotze, H.D. Matthews, D. McCauley, D. Mebratu, N. Mengis, R.H. Nolan, E. Pihl, S. Rahmstorf, A. Redman, C.E. Reid, J. Rockström, J. Rogelj, M. Saunois, L. Sayer, P. Schlosser, G.B. Sioen, J.H. Spangenberg, D. Stammer, T.N.S. Sterner, N. Stevens, K. Thonicke, H. Tian, R. Winkelmann, & J. Woodcock. 2021. Ten new insights in climate science 2021: A horizon scan. Global Sustainability, 4: e25. DOI: https://doi.org/10.1017/sus.2021.25
Monteiro, C., J. Pereira, R. Seabra, & F.P. Lima. 2022. Fine-scale survey of intertidal macroalgae reveals recent changes in a cold-water biogeographic stronghold. Frontiers in Marine Science 9: 880074. https://doi.org/10.3389/fmars.2022.880074
Ogata, E. & T. Matsui. 1965. Photosynthesis in several marine plants of Japan as affected by salinity, drying and pH with attention to their growth habitats. Botanica Marina 8: 199-217. DOI: https://doi.org/10.1515/botm.1965.8.2-4.199
Ortegón-Aznar, I., A. Chuc-Contreras, A. Tuz-Sulub & J. Santos-Flores. 2016. Cambio climático: el papel de las algas verdes calcáreas y su relación con el carbono azul. Bioagrociencias 9: 1-7.
Piñeiro-Corbeira, C., R. Barreiro, J. Cremades, & F. Arenas. 2018. Seaweed assemblages under a climate change scenario: Functional responses to temperature of eight intertidal seaweeds match recent abundance shifts. Scientific Reports 8: 12978. https://doi.org/10.1038/s41598-018-31357-x
Rilov, G. & H. Treves. 2010. Climate change effects on marine ecological communities. In: Israel et al. Eds. Role of seaweeds in future globally changing environments. Cell Origin. Springer, Berlin. https://doi.org/10.1007/978-90-481-8569-6_4
Roleda, M.Y. & C. Hurd. 2012. Seaweed Responses to Ocean Acidification. In: C. Wiencke & K. Bischof. Eds. Seaweed Biology. Ecological Studies pp. 407-431 pp. https://doi.org/10.1007/978-3-642-28451-9_19
Semesi, I., S.J. Kangwe, & M. Björk. 2009. Alterations in seawater pH and CO2 affect calcification and photosynthesis in the tropical coralline alga, Hydrolithon sp. (Rhodophyta). Estuarine, Coastal and Shelf Science 84: 337-341. https://doi.org/10.1016/j.ecss.2009.03.038
Tegner, M. & P. Dayton. 1987. El Nino effects on southern California kelp forest communities. Advances in Ecological Research 17: 243-279. https://doi.org/10.1016/S0065-2504(08)60247-0
Thuiller, W. 2007. Climate change and the ecologist. Nature 448: 550-552. https://doi.org/10.1038/448550a
Wernberg, T., B.D. Russell, M.S. Thomsen, C.F. Gurgel, C.J. Bradshaw, E.S. Poloczanska, & S.D. Connell. 2011. Seaweed communities in retreat from ocean warming. Current Biology 21: 1828-1832. https://doi.org/10.1016/j.cub.2011.09.028
Sometido: 26 de mayo de 2023
Revisado: 16 de agosto de 2023 (dos revisores anónimos)
Corregido: 25 de septiembre de 2023
Aceptado: 26 de septiembre de 2023