La diversidad inexplorada de las algas rojas continentales: algunos datos actuales y perspectivas de futuro.
The unexplored diversity of continental red algae: some current data and future perspectives.
Marina Aboal
Laboratorio de Algología, Facultad de Biología, Campus de Espinardo, Universidad de Murcia, E-30100 Murcia, España.
Corresponding author: email: maboal@um.esx
Aboal, M. 2022. La diversidad inexplorada de las algas rojas continentales: algunos datos actuales y perspectivas de futuro. Cymbella 8(2-3): 30-37.
https://doi.org/10.22201/fc.24488100e.2022.8.2-3.1
Resumen
Las algas rojas continentales, frecuentemente asociadas a condiciones prístinas, han sido poco estudiadas en general, con la excepción de algunos países, y en muchos casos están condenadas a desaparecer con su hábitat. Algunos de sus géneros aparecen recogidos en todas las monografías ficológicas, pero de la mayoría existen muy escasos datos. Recientemente se ha comprobado la enorme diversidad genómica existente en los grupos de organismos más sencillos, que son los que hicieron la transición al medio continental. Los datos genómicos deberían complementarse con estudios morfológicos, ecológicos y fisiológicos detallados que permitan completar el cuadro de la diversidad. Con el ejemplo de los avances en el estudio del grupo en la península Ibérica se resalta la importancia de infraestructuras como los herbarios y de la indispensable colaboración entre instituciones e investigadores.
Palabras clave: diversidad, estudios polifásicos, Península Ibérica, Rhodophyta.Abstract
Continental red algae, frequently associated with pristine environmental conditions, have been very poorly studied in general, except for some countries and are condemned to disappear together with their habitat. Some genera are included in most phycological monographies, but from most of them there are very scarce information. Recently the great genomic diversity of the groups gathering the simple organisms has been envisaged, those implicated in the transition from sea to continental waters. Genomic data must be complemented with morphologic, ecological, and physiological detailed studies that will permit us to have the full image of diversity. With the example of the advances in the study of the group in Iberian Peninsula it is highlighted the importance of herbaria and the indispensable collaboration between institutions and researchers.
Key words: diversity, Iberian Peninsula, polyphasic studies, RhodophytaINTRODUCCIÓN
La elaboración de floras regionales de algas continentales resulta hoy en día una necesidad, teniendo en cuenta que en muchos países se han implantado planes de evaluación de la calidad ecológica de los sistemas acuáticos, que se basan en la identificación de organismos indicadores. Sin embargo, este tipo de estudios son difíciles de abordar principalmente por dos aspectos: encontrar financiación para ellos y que los datos obtenidos difícilmente podrán ser publicados en revistas de elevado impacto, lo que se une a la escasez de taxónomos tradicionales, expertos en el trabajo de campo. Sin embargo, la carencia de estas obras dificulta enormemente o disminuye la exactitud de los trabajos técnicos ambientales, que podrían constituir una fuente muy importante de información y nutrir potentes bases de datos que hicieran posible el desarrollo de modelos predictivos, por ejemplo, ante los cambios ambientales en los que estamos inmersos.
Los recientes avances en métodos genómicos han permitido confirmar lo que ya algunos autores habían anticipado hace años: el uso de determinadas floras ha provocado sesgos en la interpretación de la biodiversidad. Es conocido el caso de cómo la utilización mundial de la Flora de Aguas Dulces de Centroeuropa (Süßwasserflora von Mitteleuropa) forzó la creencia en el cosmopolitismo de muchas especies (Eloranta et al. 2011). Hoy sabemos que existe una buena proporción de biodiversidad críptica, con muchas especies indistinguibles morfológicamente (al menos con los caracteres tradicionales) pero genéticamente diferentes. Esto ha conducido a la descripción de un número importante de nuevos taxones en todos los continentes y a confirmar que muchas especies tienen, en realidad, distribuciones restringidas (Vis & Necchi 2018).
Al abordar los estudios florísticos es importante compilar y revisar todos los trabajos previos para detectar áreas más inexploradas o con mayor diversidad ambiental, en las que centrar las recomendables prospecciones, que deben incluir una mínima caracterización ambiental, hoy muy facilitada por las sondas multiparamétricas. Esto, aunque obvio, se echa en falta en muchos casos todavía en la actualidad.
Si como decía von Stosch “uno no conoce una especie hasta que no conoce su ciclo vital” es, desde luego recomendable el aislamiento en cultivo (Stosch 1942), con todos los problemas que ello suele suponer, pero también con las enormes ventajas que proporciona el disponer de linajes con los que experimentar, tanto para inducir y conocer fases reproductoras como para forzar la producción de compuestos bioactivos o de interés comercial.
En las clasificaciones de Rhodophyta más actuales se reconocen tres subfilos: Cyanidiophytina, Proteorhodophytina y Eurhodophytina, que reflejan la gran diversidad actual de las formas más sencillas del filo, y que son mayoritariamente de ambientes continentales. Baste comprobar que en los dos primeros subfilos se agrupan 5 clases y en el último solo dos (Muñoz-Gómez et al. 2017). Esta diversidad hasta ahora reconocida casi exclusivamente a nivel genómico, genes plastidiales, debería traducirse en diversidad ecológica, fisiológica y estructural. Queda mucho por hacer. Estos autores sugieren que fueron estos grupos de rodófitas unicelulares mesofílicas de aguas dulces los ancestros de los cloroplastos rojos secundarios que poseen en la actualidad todos los grupos algales con clorofila c. Estos grupos, por tanto, tienen un gran interés evolutivo.
De muchas de estas algas rojas de estructura más sencilla desconocemos sus procesos reproductores, más allá de los meramente vegetativos o asexuales. Quizá carecen de reproducción sexual pero también es posible que estos procesos sí existan, pero se produzcan con poca frecuencia, lo que impide su observación si no es con muestreos muy intensivos, que raramente se producen. Von Stosch fue uno de los primeros en cultivar diatomeas y estudiar su reproducción “in vitro”, iniciando nuestro conocimiento en los procesos sexuales y partenogenéticos, tan frecuentes en este tipo de organismos (Stosch 1962).
Los métodos moleculares también pueden ayudar a interpretar los mecanismos reproductores de las algas rojas, buscando los genes implicados en los procesos meióticos, que son un indicador de la existencia de reproducción sexual. Este tipo de búsqueda permitió conocer que las Trebouxiophyceae, contrariamente a lo que se creía, deben presentar procesos sexuales, ya que los genes meióticos están mayoritariamente presentes en el grupo (Fučiková et al. 2015).
Con estos antecedentes, cada vez se hacen más necesarios los estudios polifásicos, que incluyan desde métodos de caracterización ambiental, hasta morfológicos, ultraestructurales y genómicos (Komárek 2016). La generalización de esta práctica no sólo permitiría generar una base de datos más completa, sino que serviría para mejorar los índices biológicos que se utilizan para la evaluación ambiental y que muchas veces no son más que copias de otros, diseñados en ambientes florísticos totalmente diferentes.
ALGUNOS DATOS SOBRE LA FLORA IBÉRICA DE LAS AGUAS DULCES
Durante el desarrollo de la Flora Ibérica de cormófitos (www.floraiberica.es), Castroviejo (1986-2012) se pudo constatar cómo la utilización de la Flora Europea impidió durante un tiempo calibrar de forma adecuada la biodiversidad de la península Ibérica. Seguramente ocurre algo similar con las algas continentales, pero no tenemos datos suficientes para asegurarlo. Lo que sí podemos asegurar es que, probablemente, esta península situada en un cruce de mundos biogeográficos es una de las más diversas del continente.
Al amparo del proyecto de la Flora Ibérica se desarrolló el programa Anthos (www.anthos.es) que tiene como objetivo la difusión a un público más diverso de los conocimientos adquiridos a lo largo de los años. Este programa es una buena fuente de información iconográfica y de distribución que resulta una ayuda inestimable en el desempeño docente. Probablemente es un sueño pensar en un equivalente para nuestras algas. Desde luego AlgaeBase se ha constituido como una referente, aunque esté más centrada en aspectos taxonómicos.
Pocos han sido los grupos de algas continentales trabajados en profundidad en la península Ibérica, pero quizá podemos mencionas las algas rojas (Rhodophyta) como un ejemplo de biodiversidad. Durante mucho tiempo los datos de que se disponía procedían de los trabajos de Margalef en España y Reis en Portugal (Chapuis et al. 2014). Esos datos siguen siendo los únicos para algunas de las regiones, a pesar del enorme lapso de tiempo transcurrido desde que estos dos insignes ficólogos desarrollaron su actividad. Lamentablemente, prácticamente todas las muestras de Margalef se perdieron (o estropearon) pero los pliegos de Reis sí se conservaron permitiendo el análisis genómico, que clarificó su asignación a nuevos géneros. Como ejemplos podemos citar las actuales Kumanoa abilii (Reis) Necchi et M.L. Vis, Kumanoa henriquesiana (Reis) Necchi et M.L. Vis, Kumanoa lusitanica (Reis) Necchi et M.L. Vis, Kumanoa pseudocarpa (Reis) Necchi et M.L. Vis y Virescentia gulbenkiana (Reis) Necchi et M.L. Vis, descritas como Batrachospermum abilii, B. henriquesianum, B. lusitanicum, B. pseudocarpum y B. gulbenkianum respectivamente (Vis & Necchi 2018).
Estos datos reflejan la importancia de los herbarios, que muchas veces están infrafinanciados y se consideran infraestructuras carentes de interés, cuando no totalmente prescindibles, con muestras que irremisiblemente se van deteriorando con el paso del tiempo. En muchos casos, sin embargo, ilustran una biodiversidad histórica, ya que las localidades prospectadas han sido desecadas o urbanizadas, imposibilitando el crecimiento algal en la actualidad. Los herbarios tienen también un importante papel en la custodia de los tipos nomenclaturales, indispensable para resolver problemas taxonómicos (Horton et al. 2017) y a los que además se pueden aplicar las modernas técnicas moleculares (De Clerck et al. 2013). Desde hace años, sin embargo, existe un debate sobre cómo conservar los materiales tipo en el futuro, abogando por la criopreservación, aunque hay muchas microalgas que no toleran las actuales metodologías empleadas a tal fin (Day et al. 2010).
Las técnicas moleculares aplicadas a los estudios sistemáticos han permitido un gran avance en la comprensión de las relaciones evolutivas de las rodófitas y han conducido a importantes cambios taxonómicos. Se puede citar como ejemplo dentro de las aguas continentales el género Batrachospermum (Fig. 2: 1) (Batrachospermaceae) que ha sido escindido en: Kumanoa, Sheathia, Virescentia, Acarposporophycos, Visia, Montagnia, Paludicola, Tortularia y Nocturama, al elevar a género muchas de las secciones previas (Vis & Necchi 2021). Es fácil encontrar las mismas especies citadas en trabajos florísticos de prácticamente todos los continentes, pero las secuencias de ADN indican que muy pocas de ellas tienen una distribución amplia en varios continentes y que la mayoría se restringen a un único continente o incluso a unas pocas localidades (Vis & Necchi 2021).
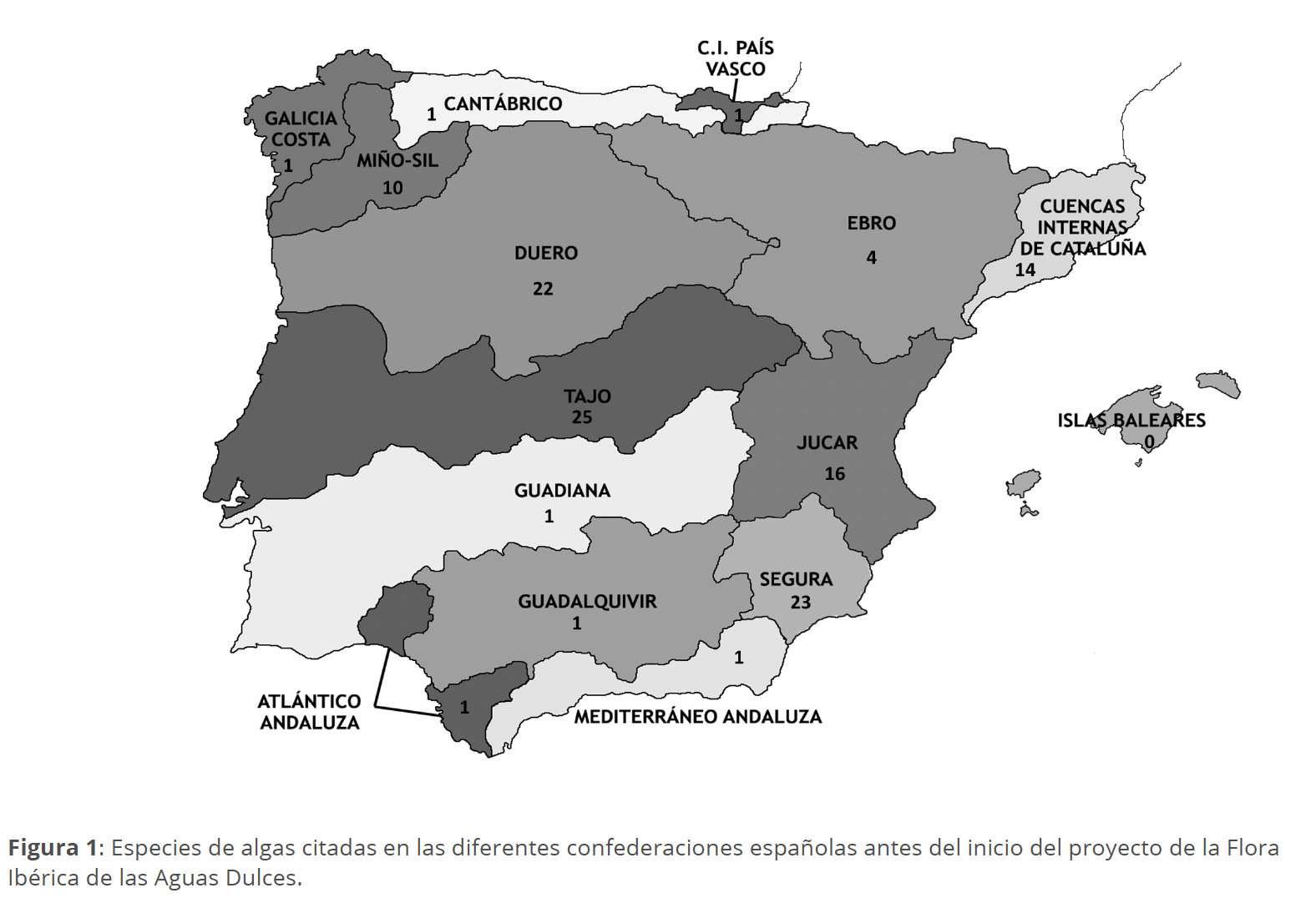
Sin embargo, estos datos pueden ir modificándose y modulándose a medida que se vaya acumulando más información, ya que el esfuerzo de muestreo y número de investigadores no es idéntico en todas las regiones. Algo similar queda claramente de manifiesto en el caso español en donde extensas cuencas hidrográficas contaban con muy escasas citas de rodófitas (Fig. 1), con datos obtenidos durante la revisión bibliográfica y lista revisada previas al inicio del proyecto de Flora Ibérica de las Aguas Dulces.
Los muestreos extensivos, centrados sobre todo en territorios poco o nada explorados dieron como resultado la descripción de un nuevo género Volatus (Chapuis et al. 2017), con especies conocidas en EE. UU., Canadá y España (V. personatus Chapuis & Vis, V. carrioni Chapuis & Vis y V. ulterior Chapuis & Vis) y cuatro nuevas especies de Batrachospermum, de las cuales sólo B. pozoazulense Chapuis & Vis se desarrolla en territorio español (Chapuis et al. 2017).
Los géneros Lemanea (Fig. 2: 2-3) y Paralemanea (Fig. 2: 5-6) son relativamente fáciles de reconocer a nivel genérico y están ampliamente extendidos en arroyos de todo el mundo, generalmente asociados a una buena calidad ecológica. Los estudios filogenéticos han evidenciado que las especies americanas y europeas están claramente separadas y que L. manipurensis Ganesan, West, Zucarello & Rout, descrita de la India, probablemente representa una divergencia antigua. Mientras L. borealis Atkinson, L. occidentalis Vis & Muller y L. parva (Vis & Sheath) Vis se distribuyen por el continente americano, L. condensata Israelson, L. fluviatilis (L) C. Agardh, L. fucina Bory y L. rigida (Sirodot) De Toni lo hacen por el europeo. En cuanto al género Paralemanea: P. blumii Vis, P. californica Blum, P. deamii (Blum) Vis, P. grandis (Wolle) Kumano, P. mexicana (Kütz.) Vis & Sheath, P. catenata (Kütz.) Vis & Sheath y P. torulosa (Roth) Shetah & Sherwood lo hacen a lo largo de Europa (Vis & Necchi 2021). Curiosamente, Paralemanea parece estar ausente en los países del norte de Europa, pero está muy extendido por los del centro y sur (Vis & Necchi 2021, Eloranta et al. 2011). Queda, sin embargo, mucho por aclarar todavía en ambos géneros tanto a nivel morfológico como molecular.
La presencia de Coralináceas era desconocida en ambientes continentales hasta que en 2016 se recolectó Pneophyllum en una zona kárstica adyacente al mar en Croacia (Zuljevic et al. 2016), pero según Vis & Necchi (2021) no es probable que se hagan más descubrimientos de este tipo. A diferencia de las otras rodófitas que penetraron en aguas continentales desde el mar, esta coralinácea desarrolla gametangios.
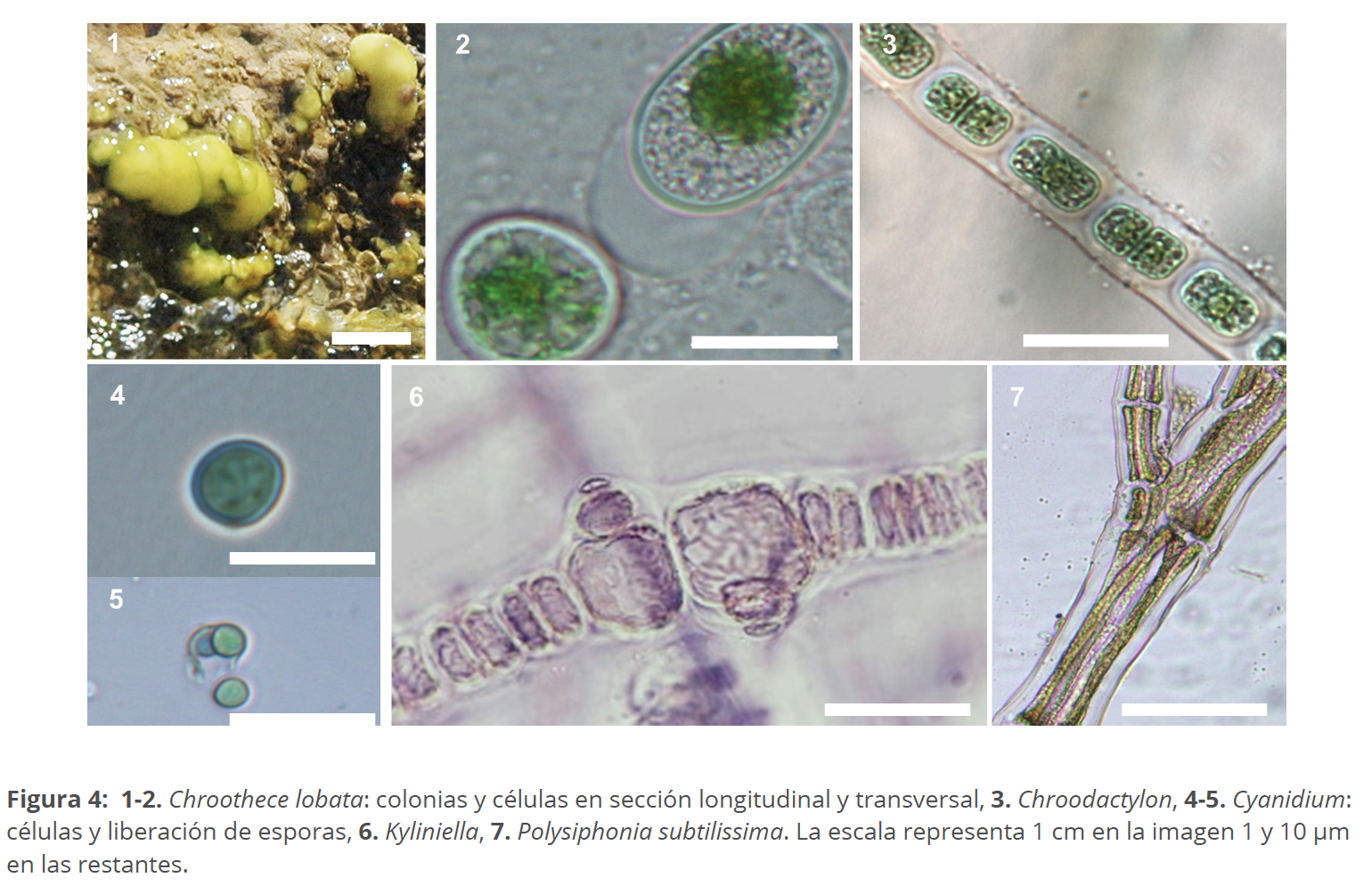
Los gametófitos de los géneros precedentes, aunque de pequeño tamaño, son conspicuos, pero otros representantes son más difíciles de reconocer en el campo. Ese es el caso de Chroothece, que sin duda tiene una distribución muchos más amplia de la conocida y está mucho más diversificado. La mayor parte de las veces sus células no llegan a desarrollar colonias de forma definida (con la excepción de C. lobata) y se manifiestan como pátinas azuladas que se desarrollan sobre paredones o suelos húmedos junto con cianofíceas y diatomeas (Pentecost et al. 2013). El interés por este género ha conducido a la descripción de dos nuevas especies: C. lobata Aboal, Whitton, Chapuis, Sánchez & Necchi y C. thermalis Chapuis, Sánchez, Aboal & Necchi (Aboal et al. 2018), además de a tener una idea mucho más precisa de sus requerimientos ecológicos (Aboal et al. 2014a) o sus posibles aplicaciones (Aboal et al. 2014b). Estos trabajos también recalcaron la importancia de acudir a las descripciones originales (muchas de ellas a libre disposición en AlgaeBase), ya que en ocasiones se arrastran interpretaciones erróneas durante mucho tiempo (Pascher & Petrová 1931, Aboal et al. 2018). Algo similar puede ocurrir con los linajes mantenidos largo tiempo en colecciones de cultivo y de los que a veces se ha perdido el rastro de su procedencia (Aboal et al. 2014a).
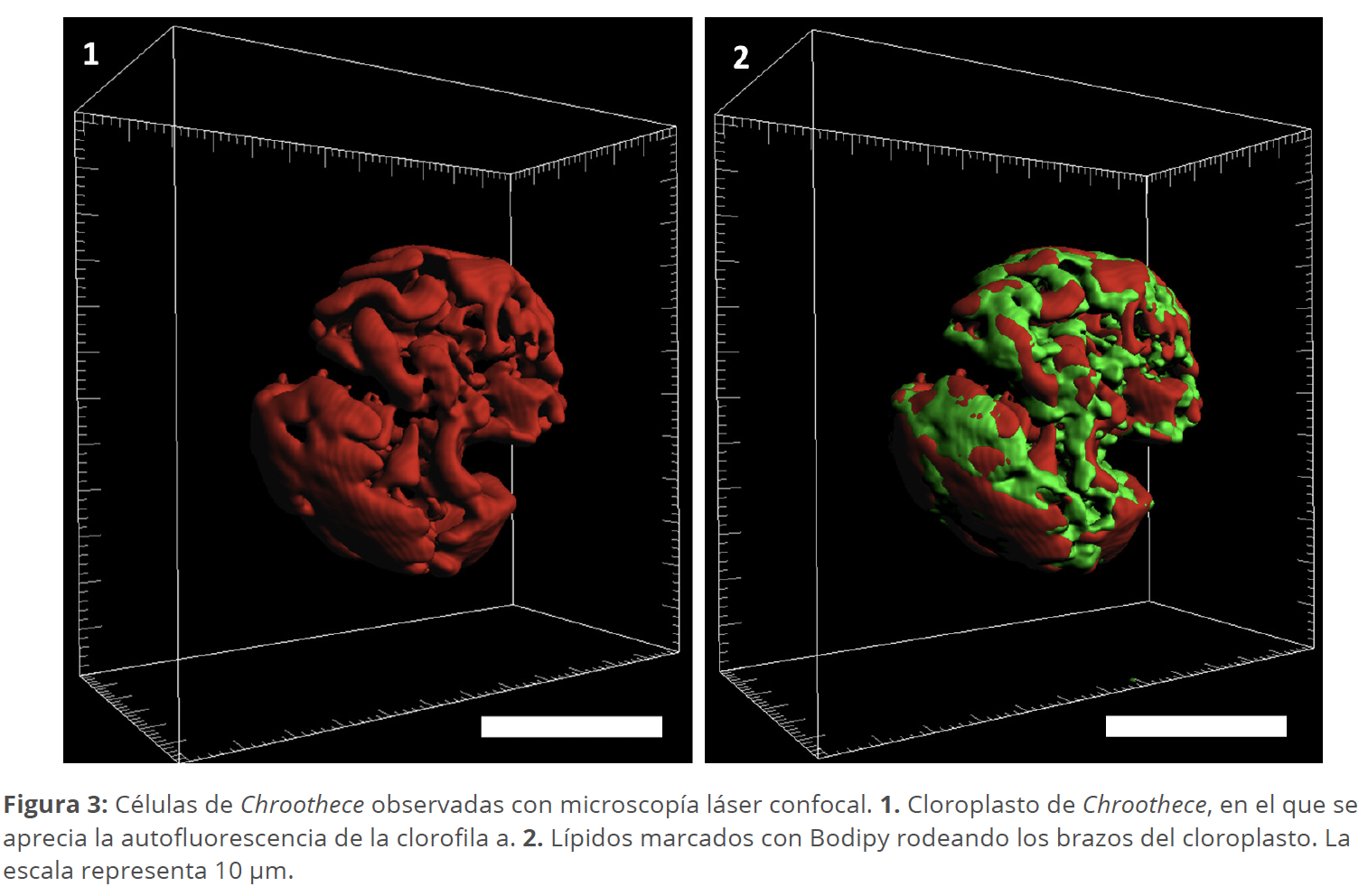
Las células (o colonias) de Chroothece (Fig. 3: 1-2, 4: 1-2) poseen una bella coloración azulada (que se torna anaranjada en lugares muy expuestos a la luz solar), pero su composición pigmentaria le permite desarrollarse tanto en cuevas con muy escasa iluminación como en lugares fuertemente iluminados (Coronado-Parra et al. 2021, 2023). La separación de especies de este género, tradicionalmente se hacía basándose en el tipo de hábitat y en las dimensiones celulares, en las que se apreciaban notables solapamientos (Eloranta et al. 2011). Rieth (1973) publicó una descripción muy detallada de una posible nueva especie del género, basada en materiales recolectados en Cuba, aunque no se decidió a describirla formalmente por tratarse de muestras fijadas.
Durante bastante tiempo se puso en duda la existencia del género Chroodactylon (Fig. 4: 3) ya que muchos Chroothece tienen fases Chroodactylon en su desarrollo, pero ambos están genéticamente separados (Aboal et al. 2018). El primero es un epífito bastante frecuente sobre Cladophora en aguas dulces, salobres o marinas, mientras que el segundo prefiere desarrollarse sobre sustratos líticos o incluso edáficos.
Estas rodófitas unicelulares o coloniales, y muchas veces azuladas, son sin duda mucho más frecuentes de lo que los datos actuales reflejan. Probablemente tienen una mayor afinidad por ambientes extremos, generalmente mucho menos estudiados.
Un ejemplo de extremófilo es el género Cyanidium (Fig. 4: 4-5) que casi siempre se creía circunscrito a aguas termales ácidas, pero del que recientemente se acumulan referencias en cuevas de terrenos alcalinos en donde colorea las paredes de un tono azul intenso (Azúa-Bustos et al. 2009, García-Fernández & Aboal 2011).
Kyliniella fue descrita de lagos eutróficos de Letonia (Skuja 1926), desarrollándose como epífita de helófitos, sin embargo, puede constituir poblaciones epilíticas muy conspicuas, por su bella coloración rosada, en las zonas de rápidos de arroyos calcáreos de montaña media en España (García-Fernández et al. 2012). También ha sido citada en lagos de Norteamérica (Flint 1953) y ríos de Sudamérica, concretamente en Brasil (Necchi et al. 2003). Si todas estas poblaciones pertenecen a la misma especie deberá dilucidarse en el futuro, aunque su crecimiento esporádico y la dificultad para hacerla crecer en el laboratorio complica mucho la tarea. Tampoco este género se libra de algunas interpretaciones erróneas: Kumano (2002) indicaba que posee cloroplastos discoidales, pero Bourrelly (2003) indicaba que son acintados. En la descripción original, Skuja (1926) los describe como acintados (Fig. 4: 6).
Las algas rojas iniciaron el paso del mar a los medios continentales hace millones de años, en un proceso que sigue observándose en la actualidad. En los años sesenta se especuló sobre el origen de Chroodactylon en los grandes lagos del norte de Estados Unidos (Sheath & Morison 1982) y más recientemente se pudo observar como Polysiphonia subtilisima Montagne (Fig. 3: 7) va subiendo desde la desembocadura a lo largo de algunas cuencas fluviales, perdiendo en el empeño su capacidad de reproducción sexual (Cantoral & Aboal 2001, Koletic et al. 2020). Bangia (Fig. 2: 4) también ha ido penetrando a distintos ecosistemas continentales (Sheath & Morison 1982), es frecuente en muchos ríos y parece que su área de distribución se va ensanchando asociada a la elevación de los niveles de eutrofia.
PROPUESTAS DE FUTURO
Los avances tecnológicos permiten en la actualidad obtener imágenes de campo o microscópicas muy rápidamente y su envío a otros lugares, cercanos o lejanos, facilitando la creación de redes de investigadores que puedan ofrecer puntos de vista alternativos.
La ciencia ciudadana, que tan de boga está en muchos lugares, se ha derivado a aspectos de conservación o detección de problemas ambientales (especies invasoras o tóxicas), no tanto a la biodiversidad. Esta es, sin duda, otra oportunidad. Las sociedades micológicas, agrupaciones de micólogos aficionados, son muy comunes en muchos países (tienen enorme tradición en el norte de España), y eso ha permitido conocer con bastante precisión la distribución de las especies de hongos (sobre todo los denominados hongos superiores) en las distintas regiones. Los ficólogos aficionados son mucho más raros, probablemente se limitan a los ambientes marinos y lamentablemente no suelen estar organizados.
¿No podrían/deberían las sociedades científicas aprovechar estas circunstancias para elaborar sus propias bases de datos, basadas en el trabajo colaborativo y la ayuda mutua? ¿Podemos promover y participar en iniciativas de Ciencias Ciudadana que involucren a las algas, aumenten el interés por estos bellos organismos y su enorme contribución al funcionamiento del planeta y a nuestro bienestar? En un mundo de redes sociales e inmediatez informativa debería ser sencillo, sobre todo si las instituciones tomaran cuenta de ello, aunque probablemente habría aspectos legales que deberían tomarse en consideración.
AGRADECIMIENTOS
A Mónica Roldán por su inestimable ayuda y asesoramiento con el microscopio láser confocal y a todos los que han colaborado a lo largo de los años en el estudio de estas pequeñas maravillas.
REFERENCIAS
Aboal, M., I. Chapuis, M.O. Paiano, P. Sánchez, J.A. West, B.A. Whitton, & O. Necchi Jr. 2018. Diversity of Chroothece (Rhodophyta, Stylonematales) including two new species. European Journal of Phycology 53: 189-197. DOI: https://doi.org/10.1080/09670262.2017.1402374
Aboal, M., M.E. García-Fernández, M. Roldán, & B.A. Whitton. 2014a. Ecology, morphology and physiology of Chroothece richteriana (Rhodophyta, Stylonematophyceae) in the highly calcareous Río Chícamo, south-east Spain. European Journal of Phycology 49: 83-96. DOI: https://doi.org/10.1080/09670262.2014.893018.
Aboal, M., D. González-Silvera, M. Roldán, M. Hernández-Mariné, J.A. López-Jiménez, & B.A. Whitton. 2014b. The freshwater alga Chroothece richteriana (Rhodophyta) as a potential source of lipids. Food Chemistry 162: 143-148. DOI: https://doi.org/10.1016/j.foodchem.2014.04.036.
Azúa-Bustos, A.C., C. González-Silva, R.A. Mancilla, L. Salas, R.E. Palma, J.J. Wynne, C.P. McKay. 2009. Ancient photosynthetic eukaryote biofilms in an Atacama Desert coastal cave. Microbial Ecology 58: 485-496. DOI: https://doi.org/10.1007/s00248-009-9500-5
Bourrelly, P. 2003. Les algues d’eau douce. Tome 3: Algues bleues et rouges. Editions N. Boubée. Paris, Francia.
Cantoral-Uriza, E.A. & M. Aboal. 2001. El marjal de Pego-Oliva: Evolución temporal de la flora de macroalgas. Limnetica 20: 159-171. Accesible en: https://www.limnetica.com/documentos/limnetica/limnetica-20-1-p-159.pdf
Castroviejo, S. (Coord. gen).1986-2012. Flora ibérica 1-8, 10-15, 17-18, 21. Real Jardín Botánico, CSIC, Madrid, España. http://www.floraiberica.es/
Chapuis, I.S., O. Necchi Jr., G.C. Zuccarello, S.-L. Xie, M. Aboal, P.M. Sánchez-Castillo, & M.L. Vis. 2017. A new genus, Volatus and four new species of Batrachopermum sensu stricto (Batrachospermales, Rhodophyta). Phycologia 56: 454-468. DOI: https://doi.org/10.2216/16-73.1
Chapuis, I.S., P.M. Sánchez-Castillo, & M. Aboal. 2014. Checklist of freshwater red algae in the Iberian Peninsula and the Balearic Islands. Nova Hedwigia 98: 213-232. DOI: https://doi.org/10.1127/0029-5035/2014/0153
Coronado-Parra, T., M. Roldán, & M. Aboal. 2021. Confocal Microscopy in Ecophysiological Studies of Algae: A Door to Understanding Autofluorescence in Red Algae. Microscopy and Microanalysis 2021: 1-9. DOI: https://doi.org/10.1017/S1431927621013660.
Coronado-Parra, T., M. Roldán, & M. Aboal. 2023. Autofluorescence Imaging to Evaluate Red Algae Physiology. Journal of visualized experiments 192: e64533. DOI: https://doi.org/10.3791/64533.
Day, J.G., T. Pröschold, T. Friedl, M. Lorenz, & P.C. Silva. 2010. Conservation of microalgal type material: Approaches needed for the 21st century science. Taxon 59: 3-6. DOI: https://doi.org/10.1002/tax.591001.
De Clerck, O., M.D. Guiry, F. Leliaert, Y. Samyn, & H. Verbruggen. 2012. Algal taxonomy: a road to nowhere? Journal of Phycology 49: 215-225. DOI: https://doi.org/10.1111/jpy.12020.
Eloranta, P., J. Kwadrans, & E. Kusel-Fetzman. 2011. Rhodophyceae and Phaeophyceae. Süsswasserflora von Mitteleuropa Band 7. Spectrum Akademischer Verlag, Heidelberg.
Flint, L.H. 1953. Kyliniella in America. Phytomorphology 3: 76-80.
Fučiková, K., M. Pažoutová, & F. Rindi. 2015. Meiotic genes and sexual reproduction in the green algal class Trebouxiophyceae (Chlorophyta). Journal of Phycology 51: 419-430. DOI: https://doi.org/10.1111/jpy.12293.
García-Fernández, M.E. & M. Aboal. 2011. Cyanidium caldarium (Tilden) Geitler (Cyanidiaceae, Cyanidiophyceae) nueva cita para la flora algal continental española. Acta Botanica Malacitana 36: 164-169. DOI: https://doi.org/10.24310/abm.v36i1.2825
García-Fernández, M.E., I. Seguí-Chapuis, & M. Aboal. 2012. Kyliniella latvica Skuja (Stylonemataceae, Stylonematophyceae), un rodófito indicador de buena calidad del agua. Limnetica 31: 341-348. DOI: https://doi.org/:10.23818/limn.31.29
Horton, T., S. Gofas, A. Kroh, G.C.B. Poore, G. Read, G. Rosenberg, S.Stöhr, N. Bailly, N. Boury-Esnault, S.N. Brandao, M.J. Costello, W. Decock, S. Dekeyzer, F. Hernández, J. Mees, G. Paulay, L. Vandepitte, B. Vanhoorne, & S. Vranken. 2017. Improving nomenclatural consistency: a decade of experience in the World Register of Marine Species. European Journal of Taxononomy 389: 1-24. DOI: https://doi.org/ 10.5852/ejt.2017.389.
Koletic, N., A.L. Alegro, A. Rimac, A. Vukovic, V. Segota, & T. Vilovic. 2020. Environmental preferences of Polysiphonia subtilissima (Ceramiales, Rhodophyta) in transitional, oligohaline and fresh waters of the East Adriatic coast. Nova Hedwigia 111 (1-2): 39-58. DOI: https://doi.org/10.1127/nova_hedwigia/2020/0593
Komárek, J. 2016. A polyphasic approach for the taxonomy of cyanobacteria: principles and applications. European Journal of Phycology 51: 346-353. DOI: https://doi.org/10.1080/09670262.2016.1163738
Kumano, S. 2002. Freshwater Red Algae of the World. Biopress, Bristol
Muñoz-Gómez, S., F.G. Mejía-Franco, K. Durnin, M. Colp, C.J. Grisdale, J.M. Archibald, & C.H. Slamovits. 2017. The new red algal subphylum Proteorhodophytina comprises the largest and most divergent plastid genomes known. Current Biology 27: 1677-1684. DOI: https://doi.org/10.1016/j.cub.2017.04.054.
Necchi Jr., O., L.H.Z. Branco, & C.C.Z. Branco. 2003. Ecological distribution of stream macroalgal communities from a drainage basin in the Serra da Canastra National Park, Minas Gerais, Southeastern Brazil. Brazilean Journal of Biology 63: 635-646. DOI: https://doi.org/10.1590/s1519-6984200300000010
Pascher, A. & J. Petrová. 1931. Über Porenapparate und Bewegung bei einer neuen (Chroothece mobilis). Archiv für Protistenkunde 74: 490-522.
Pentecost, A., B.A. Whitton, & C.F. Carter. 2013. Ecology and morphology of the freshwater red alga Chroothece in the British Isles. Algological Studies 143: 51-63. DOI: https://doi.org/10.1127/1864-1318/2013/0137
Rieth, A. 1973. Über Chroothece Hansgirg. Archiv für Protistenkunde 115: 75-98.
Sheath, R.G. & M.O. Morison. 1982. Epiphytes on Cladophora glomerata in the Great Lakes and St. Lawrence seaway with particular reference to the red alga Chroodactylon ramosum (=Asterocytis smargdina). Journal of Phycology 18: 385-391. DOI: https://doi.org/10.1111/j.1529-881.1982.tb03200.x.
Skuja, V.H. 1926. Eine neue Süsswasserbangiacee Kyliniella latvica n.g, n. sp. Acta Horti Botanici Universitatis Latviensis 1: 1-5.
Stosch, H.A. von. 1942. Form and Formwechsel der Diatomee Achnanthes longipes in Abhängigkeit von der Ernährung. Mit besondere Berücksichtigung der Spurenstoffe. Berichte der Deutsch Botanischen Gesellchaft. 60: 2-16.
Stosch, H.A. von. 1962. Über das Perizonium der Diatomeen. Vorträge aus dem Gesamtgebiet der Botanik 1: 43-52.
Vis, M.L. & O. Necchi Jr. 2018. Freshwater Red Algae. Phylogeny, Taxonomy and Biogeography. Springer, Cham.
Zuljevic, A., S. Kaleb, V. Peña, M. Despalatovic, I. Cvitkovic, O. De Clerk, L. Le Gall, A. Falace, F. Vita, J.C. Braga, & B. Antolic. 2016. First freshwater coralline alga and the role of local features in a major biome transition. Scientific Reports. 6 (19642): 1-12. DOI: https://doi.org/10.1038/srep19642.