Variación espacio-temporal de la comunidad fitoplanctónica de la Ciénaga de los Manatíes, Atlántico, Colombia
Spatial-temporal variation of the phytoplankton community of Ciénaga de los Manatíes, Atlántico, Colombia
Dina Saray Ariza-Pérez1* e Iván Martín León-Luna2
1Grupo de investigación Zona Costera. Semillero de investigación SEMARCO, Facultad de Ciencias Básicas, Universidad del Atlántico, Barranquilla, Colombia.
2 Grupo de investigación Zona Costera. Programa de Biología, Facultad de Ciencias Básicas, Universidad del Atlántico, Barranquilla, Colombia.
*Corresponding author: email: dina_saray22@hotmail.com
Ariza-Pérez, D. & I. M. León-Luna, M. 2020. Variación espacio-temporal de la comunidad fitoplanctónica de la Ciénaga de los Manatíes, Atlántico, Colombia. Cymbella 6(2): 63-77.
Resumen
Se analizó la variación espacio temporal de la comunidad fitoplanctónica en la Ciénaga de los Manatíes (CM). Para ello, se realizaron muestreos mensuales (octubre-enero), en cuatro estaciones. Se midieron las variables fisicoquímicas in situ: temperatura, oxígeno disuelto, salinidad y profundidad de Secchi. Así mismo, se calculó la densidad celular. Se encontraron 35 especies agrupadas en 5 divisiones, 6 clases, 19 órdenes, 24 familias y 29 géneros. Las euglenofitas fueron las más abundantes (90 %) y las clorofitas las menos (0.003 %). La densidad de fitoplancton fue mayor durante el periodo de lluvias (71 460 cél.L-1), cuando las euglenofitas dominaron, y en el periodo de sequía la densidad de microalgas fue menor (10 740 cél.L-1), siendo las diatomeas el grupo dominante. Enero fue el mes más diverso según los índices de diversidad aplicados. El análisis de similitud (índice de Jaccard) permitió la formación de tres grupos constituidos por las estaciones del mes de octubre, noviembre y diciembre-enero, que definen la variación de la comunidad. Según el análisis de correspondencia canónica las variaciones en salinidad explican mejor la distribución de la comunidad fitoplanctónica en la CM.
Palabras clave: Bacillariophyceae, Euglenophyceae, fitoplancton, laguna costera, variables fisicoquímicas.Abstract
The temporal spatial variation of the phytoplankton community in the Ciénaga de los Manatíes (CM) was analyzed. For this, monthly samplings were carried out (October-anuary), in four seasons. Physicochemical variables were measured in situ: temperature, dissolved oxygen, salinity and Secchi depth. Likewise, cell density was calculated. 35 species were found grouped into 5 divisions, 6 classes, 19 orders, 24 families and 29 genera. Euglenophytes were the most abundant taxon (90%) and chlorophytes the least abundant (0.003%). Phytoplankton density was higher during the rainy season (71460 cél.L-1), when euglenophytes dominated, and in the dry period the density of microalgae was lower (10740 cél.L-1), with diatoms being the dominant group. January was the most diverse month according to the applied diversity indices. The similarity analysis (Jaccard index) allowed the formation of three groups constituted by the seasons of October, November, and December – January, which define the variation in the community. According to the canonical correspondence analysis, the variations in salinity better explain the distribution of the phytoplankton community in the CM.
Key words: Bacillariophyceae, coastal lagoon, Euglenophyceae, physical-chemistry, phytoplanktonINTRODUCCIÓN.
En los últimos años el interés por la investigación en los ecosistemas estuarinos lagunares se ha incrementado notablemente debido a que su elevada productividad biológica ha sido amenazada por las actividades humanas. La eutrofización y otros tipos de contaminación que se derivan de los sectores industriales, agrícolas y urbanísticos amenazan su sustentabilidad y diversidad biológica (Ben et al. 2017, Granados et al. 2011, Mangones & León 2014, Rodríguez et al. 2017, Ruiz 2017).
El estudio de los principales eslabones que conforman las redes tróficas propias de cada ecosistema es importante para comprender su funcionamiento y estabilidad ecológica, puesto que la estructura y organización de estas comunidades dirigen la dinámica funcional del mismo (Cony et al. 2014, González 2010, Lara et al. 2015). El fitoplancton comprende la mayor porción de productores primarios y es alimento básico para los consumidores, ya que es una de las principales fuentes de incorporación de carbono en la red ecológica del ambiente limnético (Margalef 1983, Platt et al. 1992, Ramírez et al. 2010). Además, es ampliamente utilizado como indicador biológico de la eutrofización y de los procesos que se presentan en ambientes costeros, puesto que puede adquirir mayor resistencia o tolerancia a diversas sustancias, como fertilizantes, e incrementar su desarrollo y abundancia repercutiendo en la eutrofización de las aguas (Aranda 2004, De la Lanza et al. 2000, González 2010, Lara et al. 2015, Moreira et al. 2007, Troccoli et al. 2004, Vázquez et al. 2006).
La dinámica temporal y espacial de los organismos acuáticos está enmarcada en interacciones entre las variables ambientales y las características fisiológicas de los individuos (Álvarez 1981, Wetzel 1981). Los cambios dependientes del tiempo en la biomasa del fitoplancton (dinámica del fitoplancton) son inducidos por una interacción compleja de procesos físicos, químicos y biológicos (Rojas & Ortiz 2007).
Los estudios sobre dinámica de la comunidad fitoplanctónica en función de las épocas climáticas y su influencia en la distribución espacial y temporal en lagunas costeras de Colombia son muy escasos y limitados, a pesar de la importancia económica y comercial que conlleva la conservación de estos sitios tan productivos. La Ciénaga de los Manatíes es un ecosistema marino costero de gran importancia biológica y socioeconómica, ya que es un sistema en donde existe una sobretasa de energía que la convierte en una fuente importante de recursos pesqueros, así como un lugar óptimo para la crianza, refugio y crecimiento de diversas especies. El presente trabajo constituye un primer aporte al conocimiento acerca de las comunidades que integran la Ciénaga de los Manatíes, Atlántico, Colombia y su objetivo es describir la variación espacial y temporal de la comunidad fitoplanctónica y determinar su relación con la fisicoquímica de este sistema.
ÁREA DE ESTUDIO.
La Ciénaga de los Manatíes (CM), es una laguna costera ubicada en el margen noroccidental del departamento del Atlántico en jurisdicción del municipio de Puerto Colombia entre las coordenadas planas Gauss-Krüger, siguiendo el sistema de referencia Magna Sirgas (Magna Colombia Bogotá) actualizado: 1712938.276 metros norte y 909059.060 metros este en el centro de la ciénaga (Fig. 1), insertada en la subcuenca 1401-1 de la cuenca del litoral Atlántico en plena planicie fluviomarina (CRA 2007). Cuenta con un área aproximada de 1.532 km2 de espejo de agua con profundidades entre 0.42 y 1.25 m; la longitud de la barra de arena que separa la ciénaga del mar es de 0.63 km. Su forma es alargada, siendo más estrecha hacia la zona que se encuentra conectada con el mar Caribe, lo cual, en conjunto con las escorrentías naturales de tipo dendrítico, regulan la dinámica hidráulica de la misma. Al entorno de la ciénaga, la vegetación es de bosque seco tropical y prevalecen algunas de especies de mangle (Avicennia germinans y Conocarpus erectus), trupillo (Prosopis juliflora) y varias especies de cactus (CRA 2007).
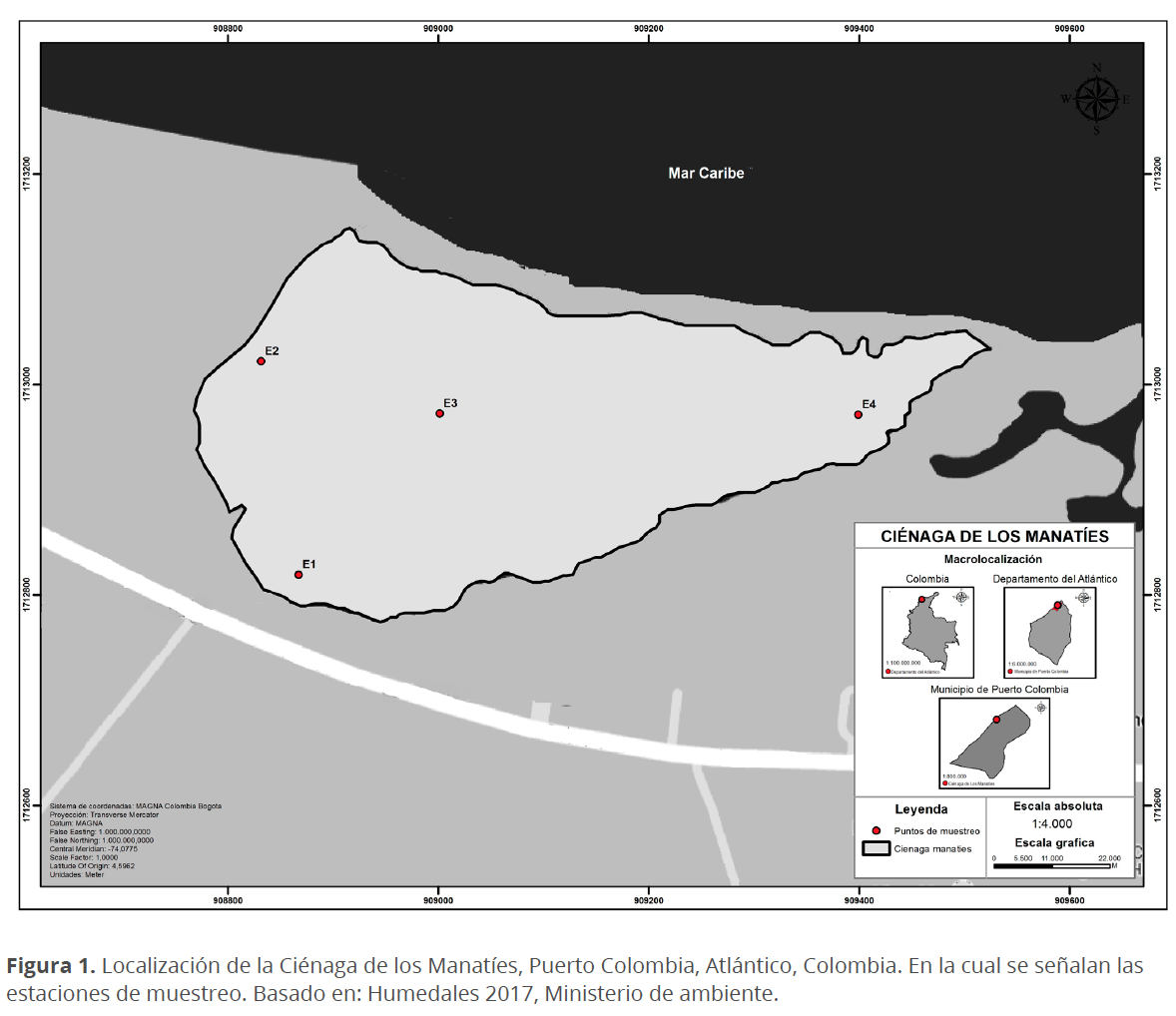
Se han observado serios problemas de sedimentación, posiblemente causados por los sedimentos provenientes del Río Magdalena que son arrastrados por el Mar Caribe hacia las costas del departamento del Atlántico y que, ayudado por la alta intervención antrópica, causan el deterioro de la CM. En 1986, el área ocupada por el espejo de agua de la CM era de 12.245 km2 aproximadamente; para 1990, este espejo de agua disminuyó considerablemente a 6.050 km2 y en el año 2005, se redujo a 2.93 km2 en el cuerpo principal de la ciénaga y 1.99 km2 en los cuerpos remanentes de la ciénaga, es decir, que entre 1986 y 2005 se perdieron 7.3 km2 en espejo de agua y gran parte del bosque de manglar asociado (INVEMAR 2007). Sin embargo, la Corporación Autónoma Regional del Atlántico (CRA) en 2015 reporta la CM con 4.12 km2, lo cual sugiere la recuperación del cuerpo de agua. Cabe resaltar que, para 1990 la CM se encontraba interconectada con la Ciénaga de Mallorquín a través de un conjunto de caños que son parte del sistema de drenaje de las cuencas de los arroyos Grande y León (CRA 2007), conexión que no se presenta en la actualidad.
MATERIALES Y MÉTODOS.
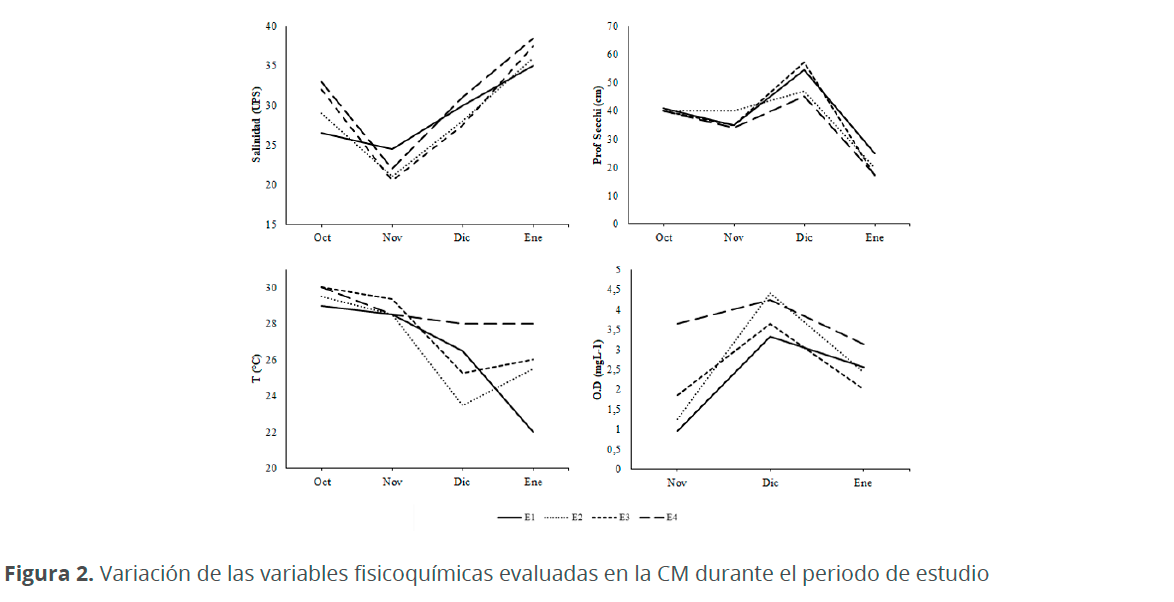
Se realizaron muestreos mensuales durante cuatro meses (octubre 2016 a enero 2017) en cuatro estaciones, teniendo en cuenta las temporadas climáticas con mayor influencia en la zona, siendo octubre-noviembre los meses de lluvia y diciembre-enero los meses de sequía (Andrade 2001) (Fig. 2). En cada estación se registraron in situ las variables fisicoquímicas: concentración de oxígeno disuelto (oxímetro), salinidad (refractómetro), temperatura (termómetro de mercurio) y profundidad Secchi. Se filtraron 30 L de agua superficial (15 cm) utilizando una red cónica simple de 55 µm de diámetro de poro y el material concentrado fue depositado en botellas plásticas de 300 mL, donde posteriormente se fijó utilizando formaldehido (4 %) (Bicudo & Menezes 2006). El análisis cuantitativo del fitoplancton se realizó utilizando una cámara de recuento tipo Sedgewick-Rafter donde se realizó el barrido completo de esta en un microscopio óptico (LABOMED Lx 400) a 100x. Con el fin de facilitar y mejorar la identificación de las diatomeas se empleó la técnica de limpieza por oxidación propuesta por Johansen et al. (1983). El medio utilizado para incluir las diatomeas fue resina artificial Naphrax® (IR>1.6) (Elosegi & Sabater 2009) y para el resto de los grupos de microalgas se utilizó gelatina glicerinada (Castro 1994). Para la identificación se utilizaron equipos de microscopia fotónica de campo claro, contraste de fases, y contraste de interferencia diferencial (Labomed Lx 400, Nikon Eclipse E400, Nikon Efd-3 y Nikon E80i) a 1000x. La identificación taxonómica se realizó hasta el nivel de especie utilizando guías especializadas (Bicudo & Menezes 2006, Dodge 1982, Hustedt 1959, Komárek & Anagnostidis 2005, Komárek 2013, Round et al. 1990, Tomas 1997, Vidal 2010, Witkowski et al. 2000).
Se realizó un análisis de varianza ANOVA con el fin de conocer si existen diferencias significativas entre la densidad celular de los distintos periodos de muestreo y se aplicó prueba de Tukey pareada con el fin de conocer entre que meses y estaciones se presentan estas diferencias. Se aplicaron los índices de dominancia de Simpson (λ) y equidad de Shannon-Wiever (H’) y Pielou (H’max) (Moreno 2001) calculados como:
λ=∑pi2 H’=∑pilnpi J’= H’
H’max
Donde;
pi = abundancia proporcional de la especie i
Hmax= ln(S)
(S)=Riqueza específica
La composición general descriptiva y el agrupamiento de los periodos de muestreo y estaciones, se basó en el índice de similitud de Jaccard. Las relaciones estadísticas entre las variables fisicoquímicas (temperatura, salinidad, oxígeno disuelto y profundidad Secchi) y la abundancia de especies fueron determinadas mediante el método multivariado de correspondencia canónica (ACC). Estos análisis se realizaron utilizando el programa Past 3.1.
RESULTADOS.
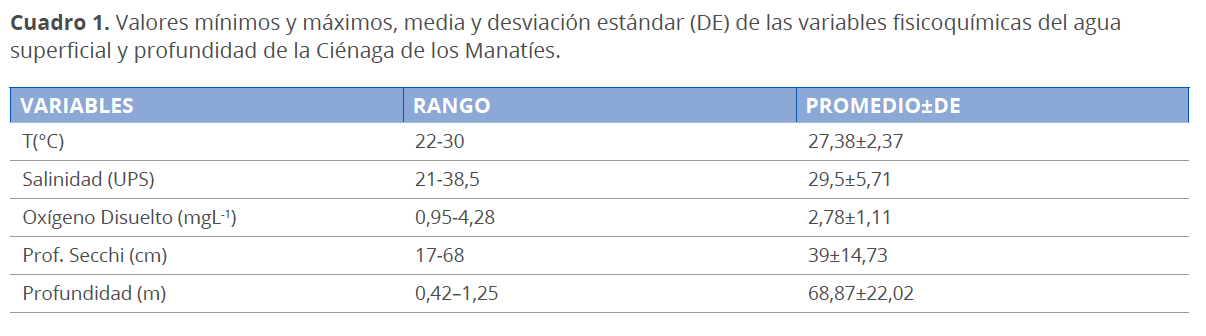
La CM se constituyó como un cuerpo de agua poco profundo (0.69 ± 0.22 m); las mayores profundidades se presentaron durante la época de lluvias (0.82 ± 0.23 m) y las menores en la época de sequía (0.56 ± 0.11m). A nivel general, la columna de agua se caracterizó por presentar aguas cálidas (>22 °C), mesohalinas (29.5 ± 5.7 UPS), muy turbias (prof. Secchi >17 cm) y bajas concentraciones de oxígeno disuelto (0.95-4.28 mgL-1) (Cuadro 1, Fig. 2).
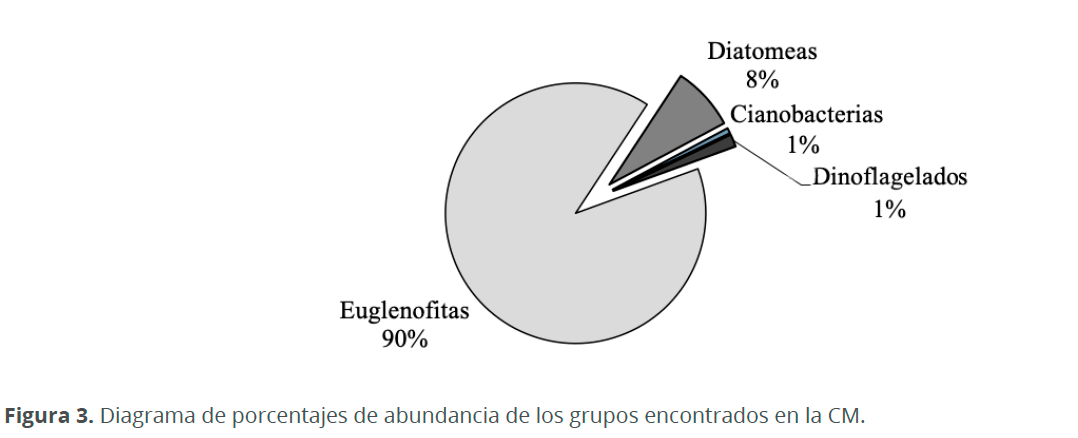
Se encontraron 35 especies de fitoplancton agrupados en 5 divisiones, 6 clases, 19 órdenes, 24 familias y 29 géneros. Los taxones más abundantes fueron euglenofitas (90%), seguido de diatomeas (8%), dinoflagelados (1.6%), cianobacterias (0.68%) y por último clorofitas (0.003%) (Fig. 3).
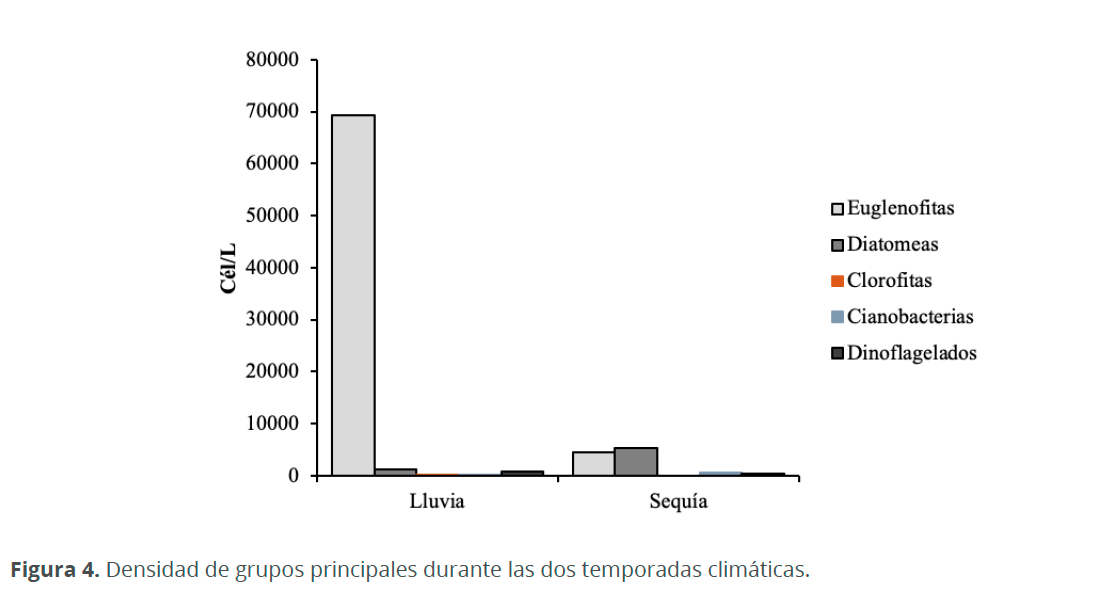
La densidad celular varió entre 640 cél.L-1 y 141,140 cél.L-1 con un valor medio general de 38,380 cél.L-1. La época de lluvia presentó el valor más alto (71,460 cél.L-1), siendo las euglenofitas el grupo dominante (69,370 cél.L-1), seguido de diatomeas (1,260 cél.L-1), dinoflagelados (840 cél.L-1) y por último cianobacterias (5.6 cél.L-1) y clorofitas (2.7 cél.L-1). Mientras que en la época de sequía la densidad celular fue menor (10,740 cél.L-1), durante este periodo las diatomeas fueron dominantes (5,260 cél.L-1), seguido de euglenofitas (4,470 cél.L-1) y por último cianobacterias (550 cél.L-1) y dinoflagelados (460 cél.L-1) (Fig. 4).
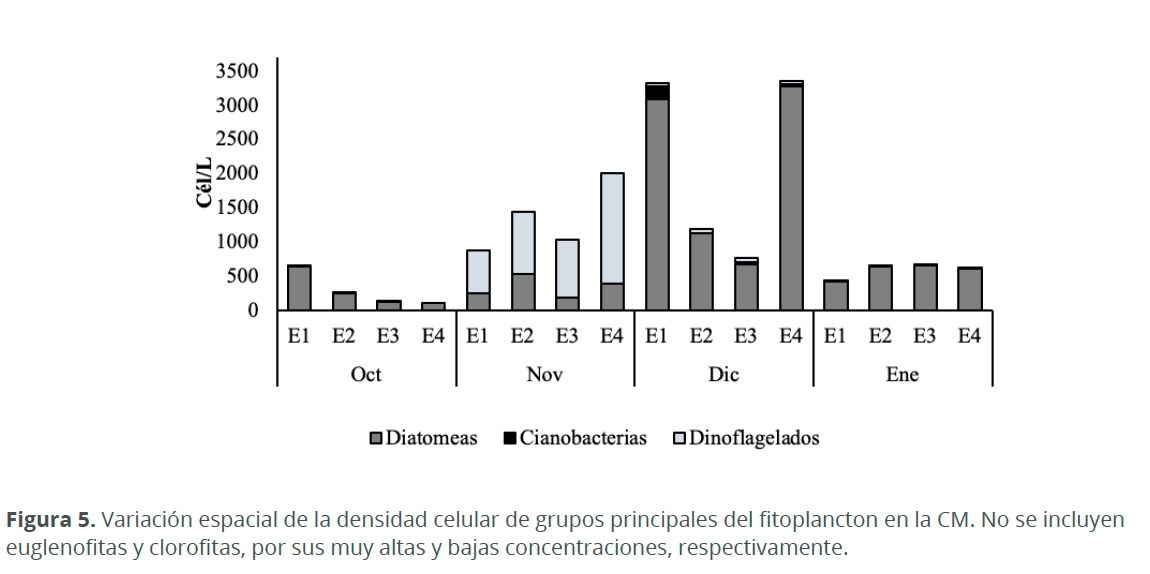
Las diatomeas dominaron durante todos los meses de muestreo, a excepción de noviembre, en donde las euglenofitas fueron más abundantes. Durante octubre se hicieron presentes casi todos los grupos; excepción fueron los dinoflagelados, al igual que en enero, cuando además de este grupo, tampoco se presentaron cianobacterias. En noviembre se destacan las altas concentraciones de euglenofitas, en especial en E4 (197,190 cél.L-1), mientras que las cianobacterias tuvieron concentraciones muy bajas (1-6 cél.L-1). En diciembre, se observaron las mayores densidades de cianobacterias (190 cél.L-1 en E1) (Fig. 5). A pesar de no observarse en la figura 5, durante el mes octubre se presentaron los grupos de euglenofitas, las cuales dominaron en E3 (1,430 cél.L-1) y las clorofitas que solo se presentaron en E2 (4 cél.L-1).
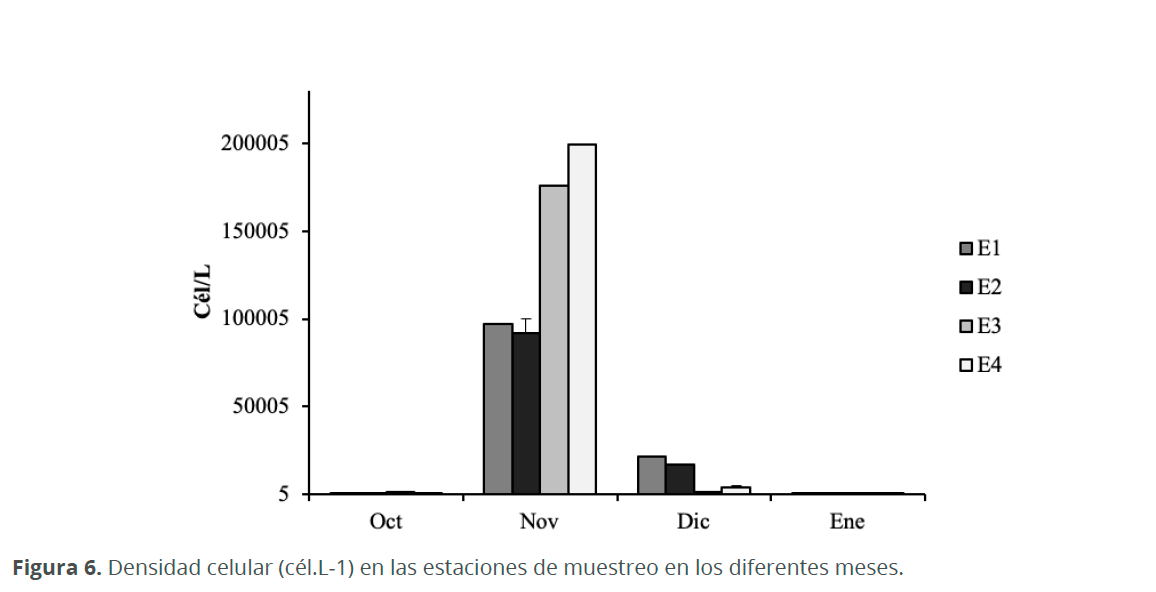
Octubre fue uno de los meses con menor densidad de microalgas, con un valor promedio de 730 cél.L-1; durante este mes E3 presentó la mayor concentración (1,570 cél.L-1), mientras E4 presentó la menor (180 cél.L-1). En noviembre la mayor concentración se presentó en E4 (199,230 cél.L-1), mientras que E2 presentó las menores concentraciones (92,010 cél.L-1). En diciembre, E1 fue la estación con mayor concentración (21,800 cél.L-1) y E3 la de menor concentración (1,480 cél.L-1). En enero, la concentración de microalgas fue muy parecida en las cuatro estaciones, con valores entre 500 y 720 cél.L-1 (Fig. 6).
Se hallaron diferencias significativas entre la densidad celular de los periodos de muestreo (α<0,05). La prueba de Tukey mostró que estas diferencias se dieron entre los meses de octubre-noviembre, noviembre-diciembre y noviembre-enero. Esta misma prueba no mostró diferencias significativas entre las estaciones de muestreo de los diferentes meses de estudio (α>0.05).
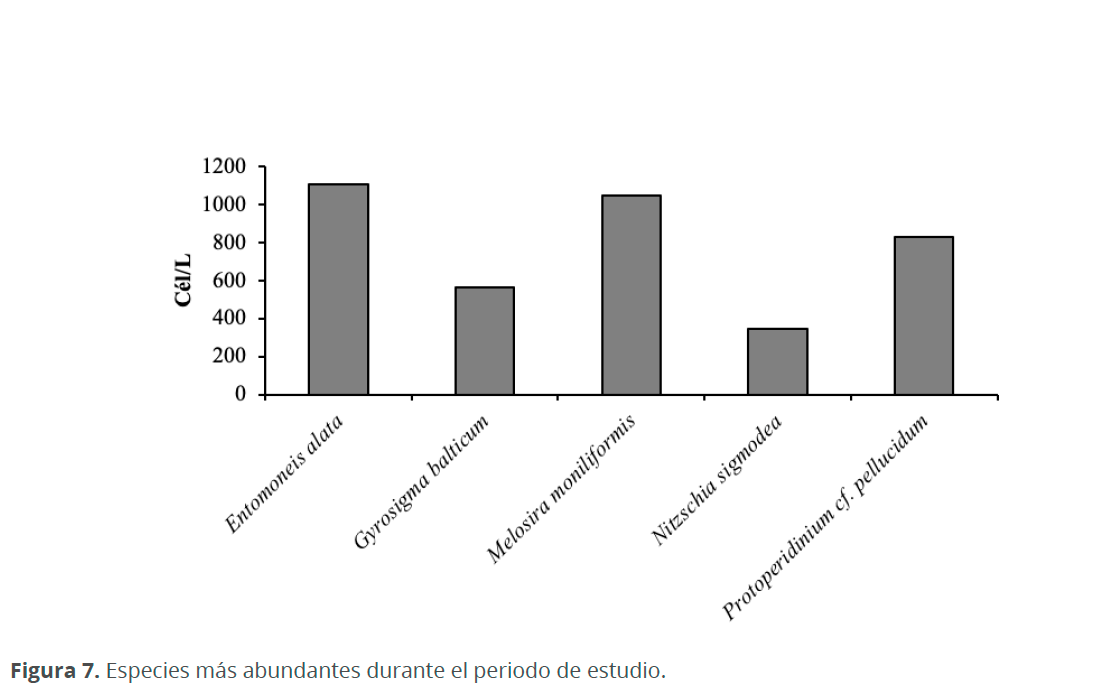
Durante el periodo en estudio, el taxón que presentó mayor densidad fue Trachelomonas sp. (36,920 cél.L-1), sin embargo, otras especies tuvieron densidades importantes durante este periodo, como Entomoneis alata (Ehrenberg) Ehrenberg (1,100 cél.L-1), Melosira moniliformis C. Agardh (1,050 cél.L-1), Protoperidinium cf. pellucidum Bergh (830 cél.L-1), Gyrosigma balticum (Ehrenberg) Rabenhorst (560 cél.L-1) y Nitzschia sigmoidea (Nitzsch) W. Smith (340 cél.L-1) (Figs. 7 y 8).
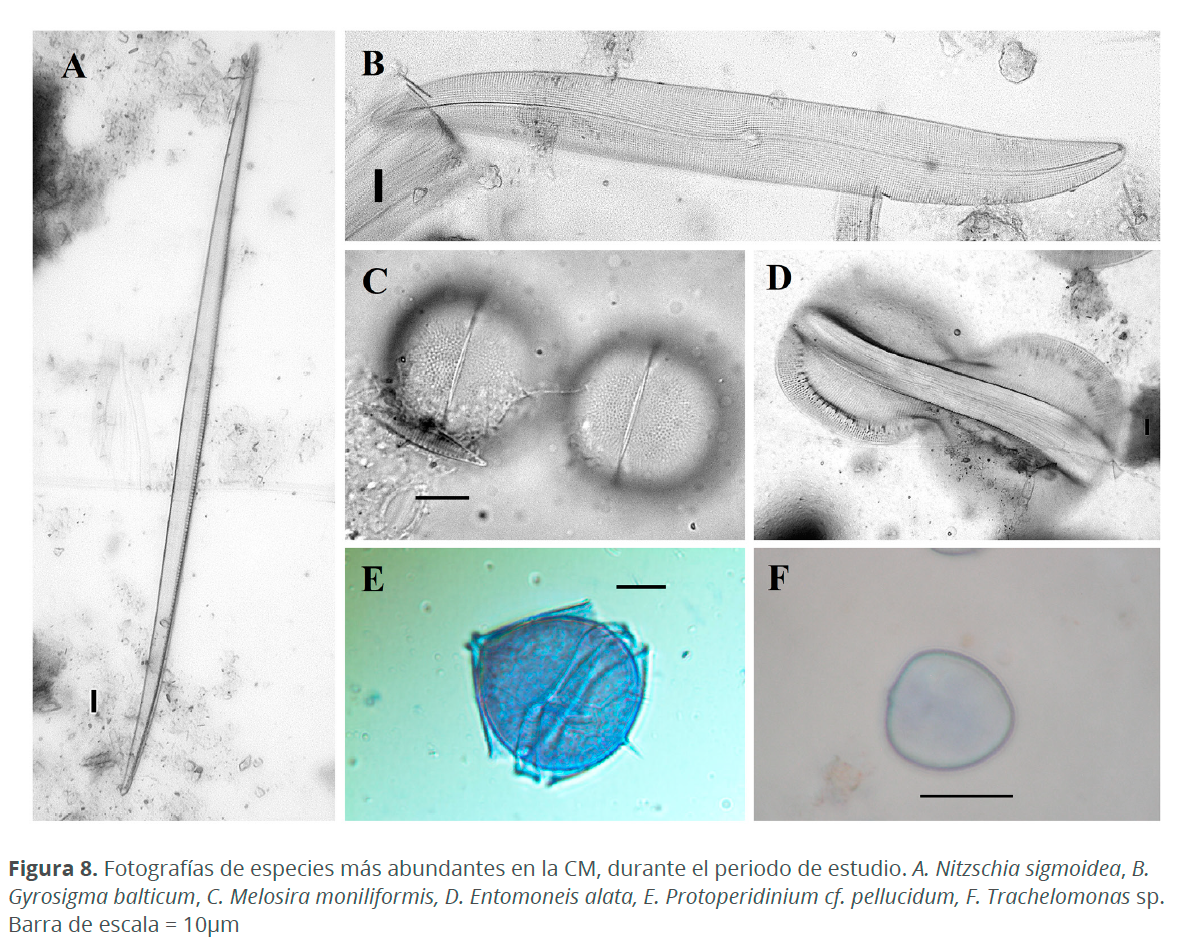
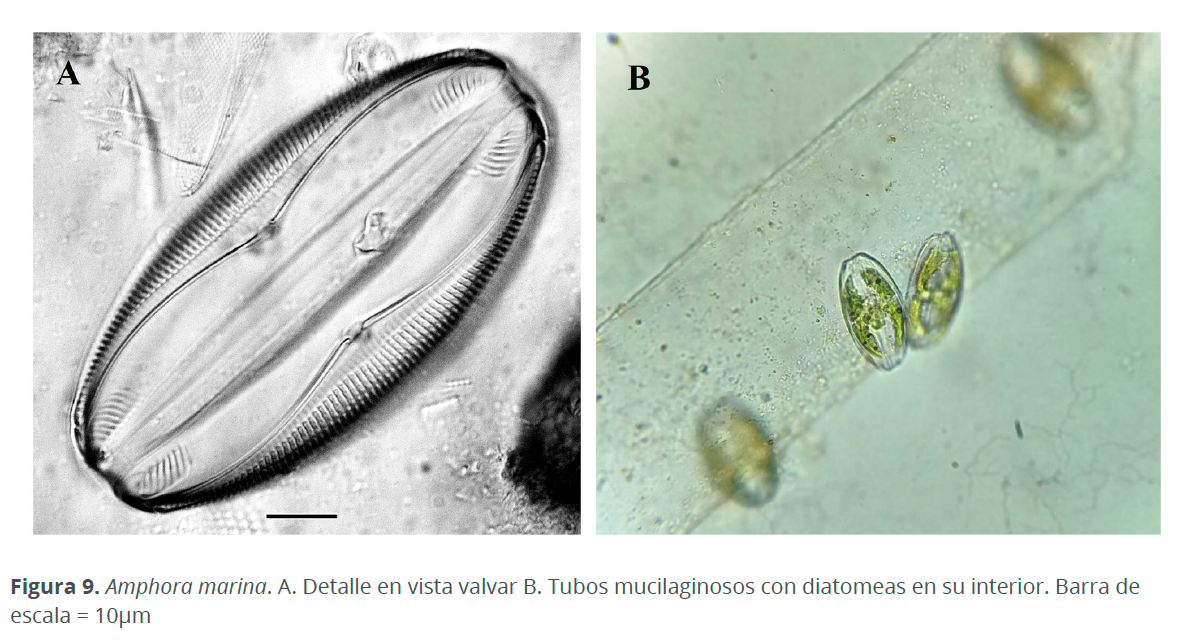
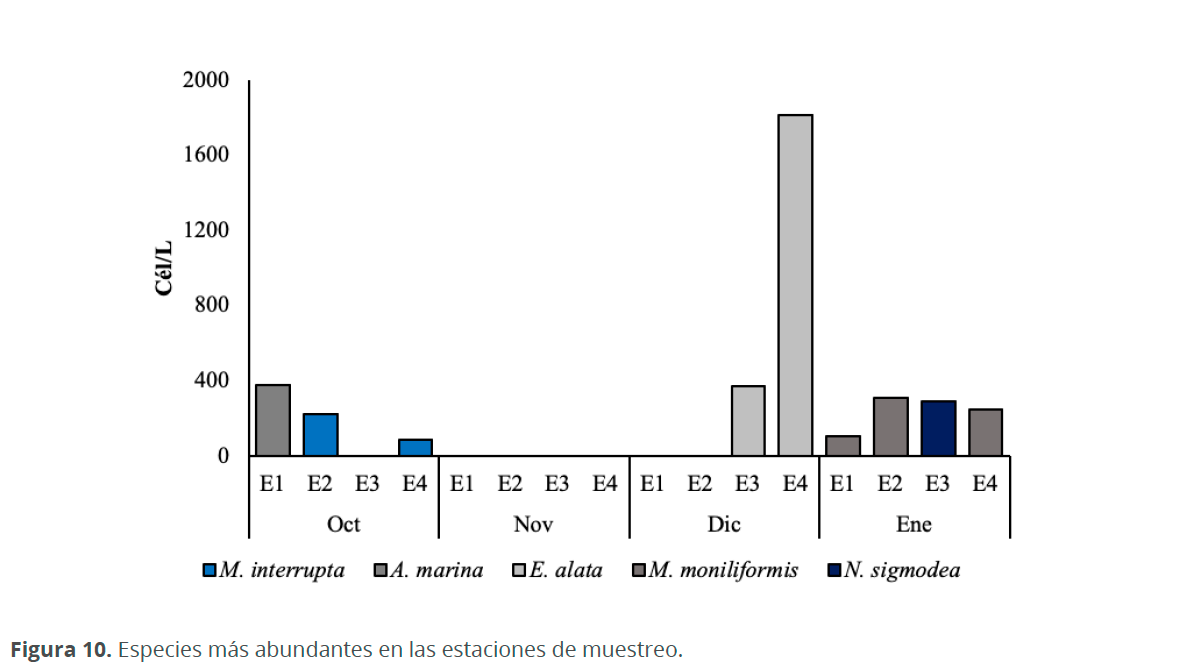
A nivel de las estaciones. En el mes de octubre, en E1 dominó Amphora marina W. Smith (370 cél.L-1), quien también se halló dentro de tubos mucilaginosos (Fig. 9), en E2 y E4 Microtabella interrupta (Ehrenberg) Round (220 y 80 cél.L-1, respectivamente) y en E3 Trachelomonas sp. (690 cél.L-1). En noviembre, en todas las estaciones dominó Trachelomonas sp. con densidades entre 108,990 cél.L-1 y 387,200 cél.L-1, presentándose las menores densidades en E2 y las mayores en E4. En diciembre, en E1 y E2 dominó Trachelomonas sp. (18,880 y 14,820 cél.L-1, respectivamente) y en E3 y E4 fue E. alata (370 y 820 cél.L-1, respectivamente). En enero M. moniliformis dominó en todas las estaciones a excepción de E3 en donde N. sigmoidea fue la especie con mayor abundancia (290 cél.L-1) (Fig. 10).
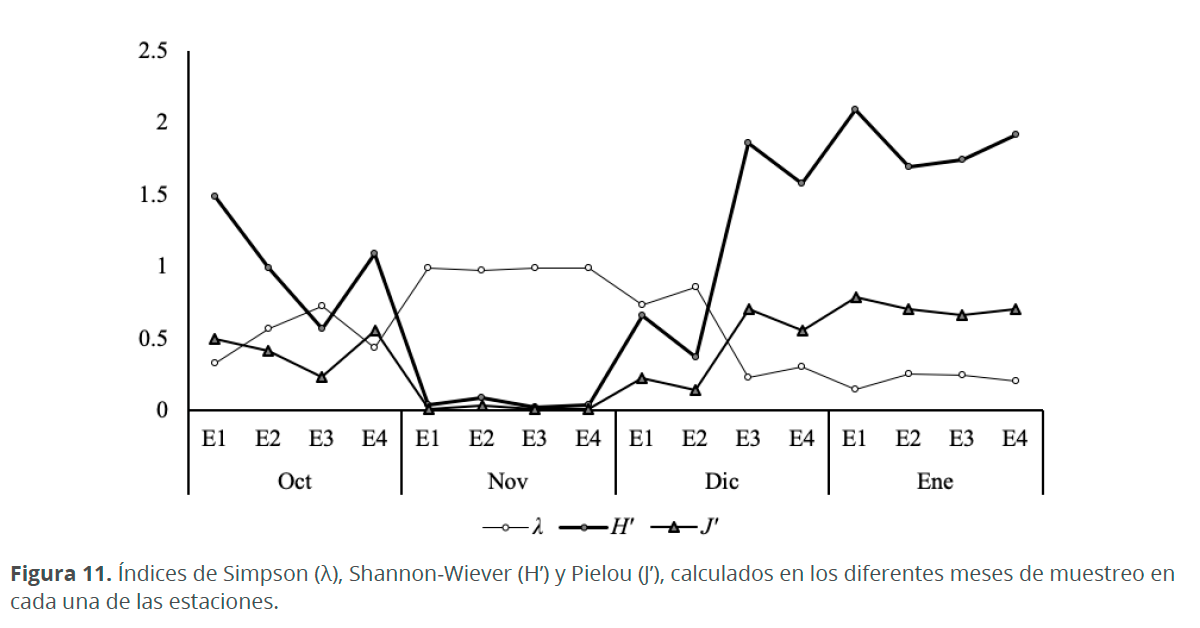
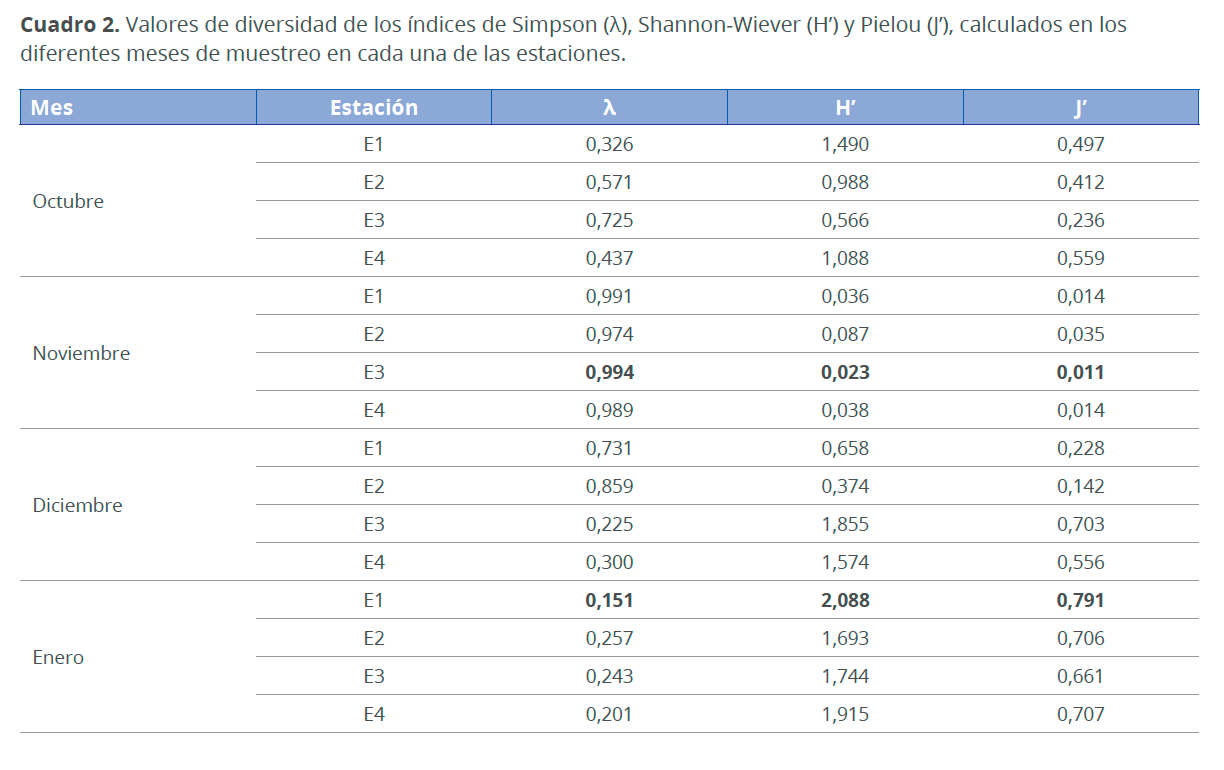
El índice de diversidad más alto se presentó en el mes de enero (H’=2.09 y J’=0.79), debido a los valores más altos de riqueza y equitatividad. El mes de noviembre presentó la menor diversidad (H’=0.02 y J’=0.01) y los valores más altos de dominancia (λ=0,99), lo cual coincide con las altas abundancias de Trachelomonas sp. La estación más diversa durante el periodo en estudio fue E1 en enero (Fig. 11) (Cuadro 2).
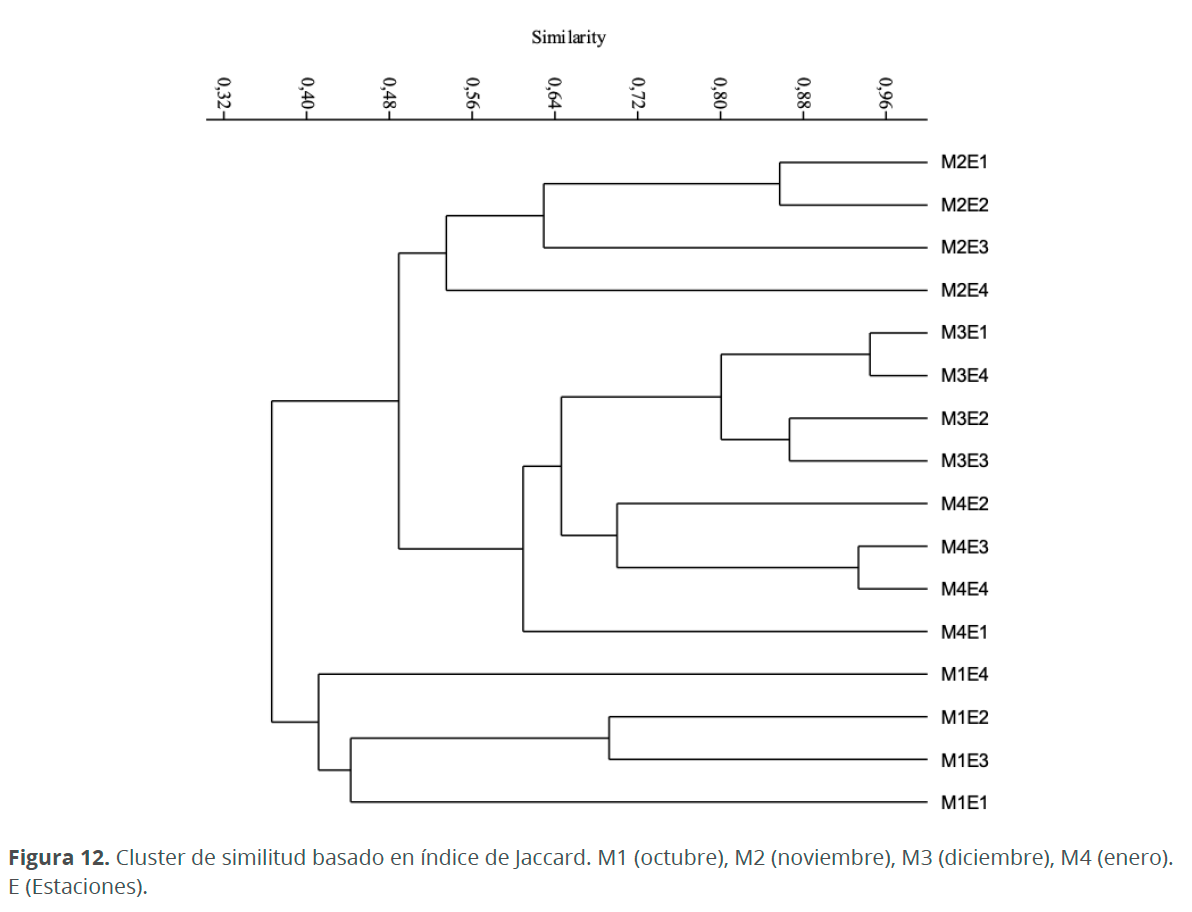
Teniendo en cuenta el análisis descriptivo multivariado no paramétrico de clasificación cuantitativa (cluster) para las estaciones y meses de muestreo bajo el índice de Jaccard (Fig. 12), existe una clara variación temporal, puesto que se muestra la formación de 3 grupos, el primer grupo está conformado por las estaciones del mes de octubre (41 %), especies como Bacteriastrum sp., Coscinodiscus radiatus Ehrenberg y Amphora terroris Ehrenberg se encontraron en por lo menos tres de las cuatro estaciones de muestreo, durante este mes y solo durante éste mismo se hallaron especies como Paralia sulcata (Ehrenberg) Cleve, Synedra bacillaris (Grunow) Hustedt, Isthmia enervis Ehrenberg, Podocystis americana Bailey, Rhopalodia musculus (Kützing) Müller y Chaetoceros sp., siendo este el mes con menor porcentaje de similaridad. El segundo grupo está conformado por las estaciones de noviembre (53 %), solo durante este mes se presentó el dinoflagelado Prorocentrum cf. lima (Ehrenberg) Stein en todas las estaciones y también se hallaron especies como Euglena sp., Tripos furca (Ehrenberg) Gómez y Scenedesmus sp. El tercer grupo lo conforman las estaciones de diciembre y enero (60 %), allí se da la formación de dos subgrupos, uno formado por las estaciones del mes de diciembre, en donde Chrysosporum bergii (Ostenfeld) Zapomelová, Skácelová, Pumann, Kopp & Janecek, Protoperidinium cf. pellucidum Bergh y Alexandrium sp. estuvieron presentes en todas las estaciones, durante este mismo mes y en enero estuvieron presentes en todas las estaciones de muestreo N. sigmoidea, Fragilaria sp., Navicula sp., y Amphora ventricosa Gregory. Las especies E. alata, A. marina, M. interrupta, G. balticum, M. moniliformis y Trachelomonas sp. se encontraron presente durante todos los meses de muestreo.
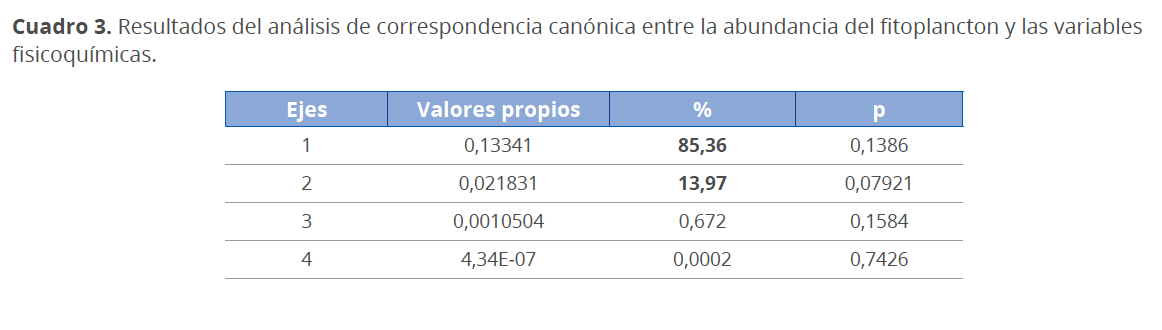
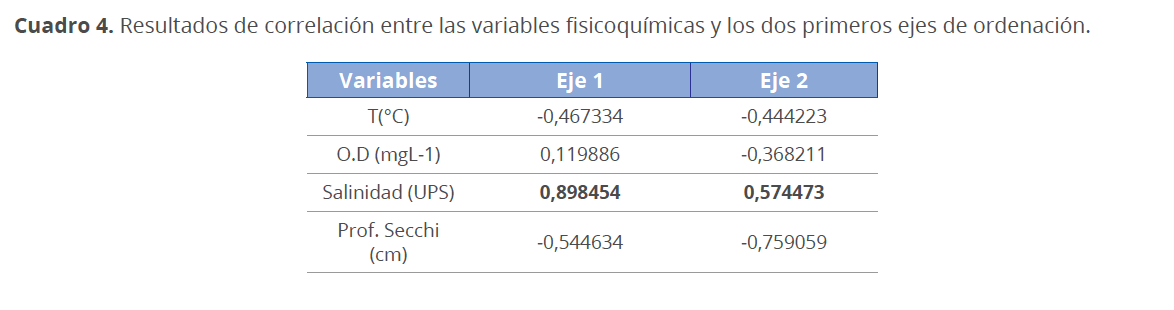
En el análisis de correspondencia canónica (ACC) se observó que la abundancia de las especies de fitoplancton está fuertemente relacionada con las variables fisicoquímicas (Fig. 13). En el diagrama, los dos primeros ejes explican un 99.33 % de la variabilidad en la abundancia de la comunidad fitoplanctónica en relación con las variables fisicoquímicas evaluadas (Cuadro 3). El eje 1 explica el 85.36 % de la variabilidad total de los datos y se correlacionó positivamente con la salinidad (0.89) y el oxígeno disuelto (O.D) (0.12) y negativamente con la temperatura (-0,47) y la profundidad Secchi (-0.54). El eje 2 explica el 13.97 % de la variabilidad total y se correlacionó positivamente con la salinidad (0,57), mientras que la profundidad Secchi (-0.76), temperatura (-0.44) y O.D (-0,37) se correlacionaron negativamente (Cuadro 4).
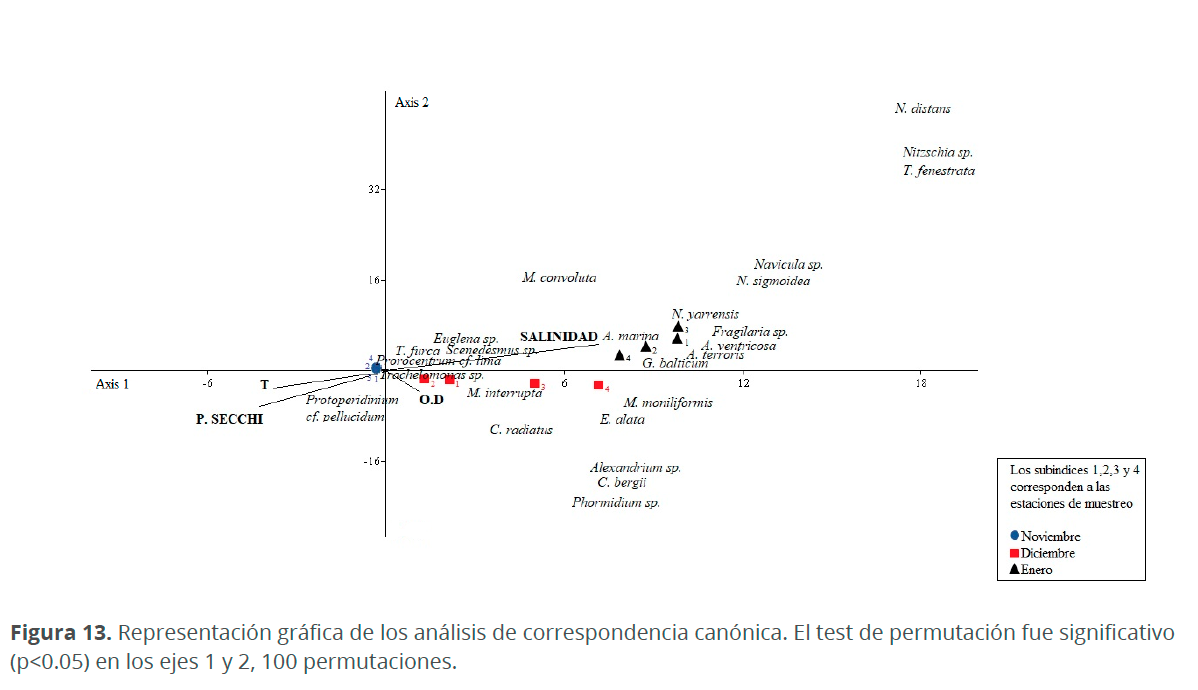
Las altas concentraciones de salinidad se correlacionaron positivamente con la mayoría de las especies, diatomeas tales como: Nitzschia sp., Tabellaria fenestrata, Navicula distans, Navicula sp., N. sigmoidea, Fragilaria sp., A. ventricosa, A. terroris, Navicula yarrensis Grunow y G. balticum se relacionaron con los valores más altos. Por otro lado, Trachelomonas sp. prefiere aguas con bajas concentraciones de salinidad al igual que el dinoflagelado Protoperidinium cf. pellucidum quien también se encuentra relacionado a altas temperaturas y aguas turbias. Phormidium sp., C. bergii, Alexandrium sp. y C. radiatus se presentaron en aguas con altas concentraciones de O.D (Fig. 13)
DISCUSIÓN.
La densidad de fitoplancton encontrado en la CM fue mucho menor que en otras lagunas costeras estudiadas por Herrera et al. (1999) y De la lanza & Gómez (1999), sin embargo, estos valores bajos coinciden con los que se presentaron en la Laguna Unare, según Subero et al. (2005). Esto posiblemente se debe a la nula conexión que tiene la CM con ríos, los cuales transportan grandes concentraciones de nutrientes que aumentan la densidad de microalgas. La mayor abundancia del fitoplancton durante las épocas de lluvia se debe a que durante este periodo incrementan los micronutrientes que son utilizados y agotados ya sea por los florecimientos del fitoplancton o por que quedan atrapados en los sedimentos. Caso contrario ocurre durante el periodo de la sequía, en donde la dinámica del sistema se atenúa, creando un ambiente hipersalino que permite la colonización de especies estenobióticas las cuales presentan ajustes a la hipersalinidad como secreciones mucilaginosas que actúan como una barrera contra la desecación (Siqueiros 1988), tal fue el caso de Amphora marina, quien también se halló dentro de estos tubos mucilaginosos. Debido a estas condiciones de hipersalinidad no proliferan muchas especies y por ello la riqueza de especies en la CM es muy baja. Los mayores valores del índice de Pielou durante el mes de enero indican que las especies presentan abundancias similares y confirman la uniformidad de la comunidad fitoplanctónica en este periodo. El porcentaje de euglenofitas encontradas fue superior al de los otros grupos (90 %). Sin embargo, sin tener en cuenta las euglenofitas, por su elevada concentración, el porcentaje de diatomeas (77%) y de dinoflagelados (20%), coincide con lo encontrado por Troccoli et al. (2004) quienes encontraron porcentajes de 75-90 % y 10-25 %, respectivamente. Al igual que en otros sistemas estuarinos predominaron las diatomeas durante todas las épocas de muestreo, a pesar de que gran parte de está dominancia se debe a la gran flexibilidad ecológica de este grupo (Margalef 1983), la mayoría de las especies registradas en este trabajo son bentónicas y aportan una fuente de enriquecimiento del fitoplancton (ticoplancton) sobre todo en las lagunas costeras con elevada producción primaria (Siqueiros 1988).
Particularmente, durante la época de sequía, se ha establecido que las partículas suspendidas experimentan un proceso de advección, asentamiento y resuspensión que facilita la retención de éstas, incluyendo diatomeas (Varona & Gutiérrez 2006), es por ello que en este periodo se presentó mayor abundancia de éstas. Esto también explica la presencia de varias especies ticoplanctónicas en la columna de agua como Entomoneis alata, especie verdaderamente estuarina, como lo establecen Varona & Gutiérrez (2006). Durante la época de lluvia, ingresa al sistema agua dulce proveniente de las escorrentías y con ello altas densidades de euglenofitas, todas de la especie Trachelomonas sp., las cuales son predominantemente dulceacuícolas. En noviembre, además de la presencia de Trachelomonas sp., se presentó un aumento significativo de Protoperidinium cf. pellucidum Bergh, especie que Lozano et al. (2011) reportaron para el Caribe Colombiano. La presencia de dinoflagelados en este mes permite explicar la época con mayor influencia del mar sobre la laguna (Varona & Gutiérrez 2006). Como resultado de mayor intercambio con el mar adyacente, en E4, ingresan al sistema un gran número de especies neríticas.
Los análisis de correlación aplicados en el presente trabajo mostraron que la salinidad influye de forma positiva en la distribución de la comunidad fitoplanctónica de la CM. Esto coincide con los estudios realizados por De la Hoz (2004) y Varona & Gutiérrez (2003), quienes afirman que la salinidad es uno de los factores más determinantes en la presencia y distribución de los grupos del fitoplancton en lagunas costeras. Los altos valores de salinidad presentados en la CM durante los meses de sequía podrían explicar las bajas densidades de microalgas, ya que durante este periodo existe una limitación de nutrientes como el nitrógeno y fósforo causada por la alta salinidad, que es la situación más generalizada en cuanto a limitación de nutrientes en aguas dulces y marinas (Comín et al. 1987).
La heterogeneidad planctónica observada durante los meses de lluvia está relacionada con la contribución de especies bentónicas debido a la alta relación superficie/volumen de la laguna y con el gradiente de salinidad creado por la combinación de los dos tipos de agua diferentes (Herrera et al. 1999). Especies como Entomoneis alata son un ejemplo claro de los constantes procesos de resuspensión de sedimentos, ya que además de ser una especie característica de cuerpos de aguas salobres (Spiniello 1996) es considerada una especie bentónica (Delgado 1987, en Vidal 2010).
CONCLUSIONES.
Se encontraron 35 especies, entre diatomeas, dinoflagelados, euglenofitas, clorofitas y cianobacterias. En su mayoría marinas o de aguas salobres. Siendo, Entomoneis alata, la especie más representativa en el periodo de estudio presentándose en todos los meses de muestreo, ya que es propia de ambientes salobres y estuarinos. Igualmente, la comunidad fitoplanctónica exhibió varias proliferaciones causadas por euglenofitas del género Trachelomonas. En general, la heterogeneidad planctónica es debida a la poca profundidad de la laguna, su ubicación latitudinal y la resuspensión de los sedimentos causada por acción de los vientos.
La composición de la comunidad fitoplanctónica varía en función de las épocas climáticas establecidas (lluvia y sequía), lo que provoca la variación temporal de la comunidad fitoplanctónica, la cual es clara en cuanto a la densidad celular y las especies que se hacen presente durante cada mes, sin embargo, no se observó una variación espacial, lo que sugiere la homogeneidad del cuerpo de agua.
AGRADECIMIENTOS.
Al Laboratorio de Algas Continentales: Ecología y Taxonomía (LACET) de la Universidad Nacional Autónoma de México (UNAM), en especial al Dr. Eberto Novelo por su acompañamiento y valiosa orientación en la identificación de las especies. Al profesor Alfonso Vidal por su asesoría y ayuda en la identificación de las especies. Al laboratorio de Biotecnología microbiana y Bioprospección Microbiana de la Universidad del Atlántico, donde se llevaron a cabo los recuentos.
REFERENCIAS
Álvarez, F. 1981. Introducción a la ecología del mar. Fascículos de ecología II. Editorial Mejoras, Bogotá.
Andrade, C.A. 2001. Las corrientes superficiales en la cuenca de Colombia observadas con boyas de deriva. Revista de la academia colombiana de ciencias exactas, físicas y naturales 25: 321-335.
Aranda, N. 2004. Eutrofización y calidad del agua de una zona costera tropical. Tesis de doctorado. Universidad de Barcelona. 246 pp.
Ben, H., O. Pringault, H. Louati, A. Sakka & C. Leboulanger. 2017. Impact of contaminated sediment elutriate on coastal phytoplankton community (Thau lagoon, Mediterranean Sea, France). Journal of Experimental Marine Biology and Ecology 486: 1-12.
Bicudo, C.E. & M. Menezes. 2006. Gêneros de algas de águas continentais do Brasil (chave para identificação e descrições)-Segunda edição. RiMa Editora, São Carlos.
Castro, T. 1994. Preparación de placas permanentes para microalgas dulceacuícolas. Tesis de licenciatura. Universidad de Guadalajara. 58 pp.
Comín, F.A., M. Menéndez & E. Forés. 1987. Salinidad y nutrientes en las lagunas costeras del delta del Ebro. Limnética 3: 1-8.
Cony, N.L., N.C. Ferrer & E.J. Cáceres. 2014. Evolución del estado trófico y estructura del fitoplancton de un lago somero de la región pampeana: laguna Sauce Grande (Pcia. de Buenos Aires, Argentina). Biología Acuática 30: 79-91.
Corporación Autónoma Regional del Atlántico (CRA). 2007. Documentación del estado de las cuencas hidrográficas en el departamento del Atlántico, Barranquilla, pp. 80-82.
Corporación Autónoma Regional del Atlántico (CRA). 2015. Monitoreo fisicoquímico, microbiológico e hidrobiológico sobre la calidad y estado de los cuerpos de agua, las fuentes hídricas del departamento del Atlántico y la caracterización de los humedales Sabanagrande, Santo Tomás y Palmar de Varela en cumplimiento de lo establecido en el plan de acción institucional 2012-2015. Informe final, Barranquilla, pp. 2-6.
De la Hoz, M.V. 2004. Dinámica del fitoplancton de la ciénaga Grande de Santa Marta, Caribe Colombiano. Boletín de investigaciones marinas y costeras 33: 159-179.
De la Lanza, G. J. & S. Gómez. 1999. Fisicoquímica del agua y cosecha de fitoplancton en una laguna costera tropical. Ciencia ergo sum 6: 147-153.
De la Lanza, G.J., S. Hernández & J.L Carbajal. 2000. Organismos indicadores de la calidad del agua y de la contaminación (Bioindicadores). Plaza y Valdés, México.
Delgado, M. 1987. Fitoplancton de las bahías del Delta del Ebro. Investigación Pesquera 51: 517-548.
Dodge, J.D. 1982. Marine dinoflagellates of the British Isles. London: Her Majesty’s Stationery Office, London.
Elosegi, A. & S. Sabater. 2009. Conceptos y técnicas de ecología fluvial. Primera edición. Rubes editorial, Bilbao, pp. 224-226.
González, L.M. 2010. Influencia de la deficiencia de nitrógeno y fósforo en las interacciones competitivas entre Chlorella vulgaris y Scenedesmus acutus. Tesis de Maestría. Universidad Nacional de Colombia. 65 pp.
Granados, C., J. Rodríguez, & H. López. 2011. Producción primaria fitoplanctónica y metabolismo durante una época lluviosa en una laguna costera estuarina tropical, Ciénaga Grande de Santa Marta. Intropica 6: 9-19.
Herrera, J.A., M. Martín & V. Díaz. 1999. Variaciones del fitoplancton en cuatro lagunas costeras del Estado de Yucatán, México. Revista de Biología Tropical 47 (Supl. 1): 47-56.
Hustedt, F. 1959. Die kieselalgen Deutschlands, Österreichs y der Schweiβ. In L. Rabenhort. Ed. Kryptogammen-Flora. VII Banda, II Teil. Koeltz, Dehra Dun.
Instituto de investigaciones marinas y costeras (INVEMAR) & Corporación regional autónoma del Atlántico (CRA). 2007. Ordenamiento Ambiental de la Zona Costera del Departamento del Atlántico. Informe Final. Instituto de investigaciones marinas y costeras, Santa Martha.
Johansen, J.R., S.R. Rushforth, R. Orbendorfer, N. Fungladda & J.A. Grimes. 1983. The algal flora of selected wet walls in Zion National Park, Utah, USA. Nova Hedwigia 38: 765-808.
Komárek, J. 2013. Cyanoprokaryota: 3rd part: heterocystous genera. In: B. Büdel, G. Gärtner, L. Krienitz, & M. Schagerl. Eds. Süsswasserflora von Mitteleuropa Vol. 19. Springer Verlag Springer Spektrum, Heidelberg.
Komárek, J. & K. Anagnostidis. 2005. Süsswasserflora von Mitteleuropa Cyanoprokaryota 2. Teil: Oscillatoriales. In: B. Büdel, L. Krienitz, G. Gärtner, M. Schagerl. Süsswasserflora von Mitteleuropa Vol. 19. Elsevier GmbH, Munchen.
Lara, R., R. Velásquez, L. Troccoli, D. Hernández & M. Lemus. 2015. Variación temporal de las variables físico-químicas y biomasa fitoplanctónica en aguas superficiales de la zona costera de Chacopata, NE Venezuela (Mar Caribe). Revista de Biología Marina y Oceanografía 50: 367-373.
Lozano, Y., L.A. Vidal & G.R. Navas. 2011. Lista de especies de dinoflagelados (Dynophyta) registrados en el mar Caribe Colombiano. Boletín de investigaciones marinas y costeras 40: 361-380.
Mangones, A. & I.M. León. 2014. Elementos nutritivos la clorofila a y su relación con las variables fisicoquímicas en la Ciénaga de Mallorquín, Colombia. Boletín del Instituto Oceanográfico de Venezuela 53: 127-141.
Margalef, R. 1983. Limnología. Ed. Omega, Barcelona.
Moreira, A.R., M. Seisdedo, S. Leal, A.A Comas, G. Delgado, R. Regadera, C. Alonso, A. Muñoz & M. Abatte. 2007. Composición y abundancia del fitoplancton de la Bahía de Cienfuegos, Cuba. Revista de Investigaciones Marinas 28: 97-109.
Moreno, C. E. 2001. Métodos para medir la biodiversidad. M&T–Manuales y Tesis SEA, vol. 1., Zaragoza.
Platt, T., P. Jauhary & S. Sathyebdranath. 1992. The importance and measurement of new production. In: P. Falkowski & A. Woodhead. Eds. Primary productivity and biogeochemical cycles in the sea. Environmental Science Research, vol 43. Springer, Boston, pp. 273-284.
Ramírez, J.S., A. Franco, L.M. García & D.A. López. 2010. La comunidad fitoplanctónica durante eventos de surgencia y no surgencia, en la zona costera del departamento del Magdalena, Caribe Colombiano. Boletín de Investigaciones Marinas y Costeras 39: 233-263.
Rodríguez, L., M. Achkar, O. Defeo, L. Vidal, E. Meerhoff & D. Conde. 2017. Effects of land use changes on eutrophication indicators in five coastal lagoons of the Southwestern Atlantic Ocean. Estuarine, Coastal and Shelf Science 188: 116-126.
Rojas, P.J. & J.R. Ortiz. 2007. Comportamiento del fitoplancton durante el evento ENOS en el Océano Pacífico colombiano. Ingeniería de Recursos Naturales y del Ambiente 6: 5-15.
Round, F.E., R.M Crawford & D.G. Mann. 1990. The Diatoms. Biology and morphology of the genera. Cambridge University Press, Cambridge.
Ruiz, T.M. 2017. Análisis comparativo de índices de eutrofización en lagunas costeras del estado de Sonora México. Tesis de doctorado. Centro de Investigaciones Biológicas del Noreste, S.C. La Paz, Baja California Sur. 120 pp.
Siqueiros, D.A. 1988. Diatomeas bentónicas de la Laguna Figueroa, Baja California. Benthic Diatoms from Laguna Figueroa, Baja California. Ciencias Marinas 14: 85-112.
Spiniello, P. 1996. Las diatomeas Marino-Costeras de Venezuela. Caribbean Journal of Science 32: 331-347.
Subero, S., J. Díaz & E. Ferraz. 2005. Variación espacial y temporal del fitoplancton de la laguna Unare (Estado Azoátegui, Venezuela), noviembre 1988- Julio 1989. Acta científica venezolana 56: 98-102.
Tomas, C.R. 1997. Identifying marine phytoplankton. Academic Press, New York.
Troccoli, L., J.A. Herrera & F.A Comin. 2004. Structural variations of phytoplankton in coastal seas of Yucatan, México. Hydrobiologia 519: 85-102.
Varona, F. & F.J. Gutiérrez. 2003. Estudio multivariado de la fluctuación espacio temporal de la comunidad fitoplanctónica en dos lagunas costeras del estado de Chiapas. Hidrobiológica 13: 177-194.
Varona, F. & F.J. Gutiérrez. 2006. Composición estacional del fitoplancton de dos lagunas costeras del Pacífico tropical. Hidrobiológica 16: 159-174.
Vázquez, G., G. Castro, I. González, R. Pérez & T. Castro. 2006. Bioindicadores como herramientas para determinar la calidad del agua. ContactoS 60: 41-48.
Vidal, L.A. 2010. Manual de fitoplancton hallado en la Ciénaga grande de Santa Marta y cuerpos de agua aledaños. Fundación Universidad de Bogotá Jorge Tadeo Lozano. Bogotá.
Wetzel, R.G. 1981. Limnología. Editorial Omega, Barcelona.
Witkowski, A., H. Lange-Bertalot & D. Metzeltin. 2000. Diatom flora of marine coasts. Iconographia diatomologica, Vol. 7, Diversity-Taxonomy-Identification Gantner, Rugell.
Recibido: 21 de septiembre de 2018.
Revisado: 28 de noviembre de 2018.
Corregido: 17 de agosto de 2020.
Aceptado: 20 de agosto de 2020.
Revisores: Tres revisores anónimos.