Diversidad de Halymeniaceae (Halymeniales, Rhodophyta) en México
Diversity of Halymeniaceae (Halymeniales, Rhodophyta) in México
José Federico Rosas Ortíz1, María Luisa Núñez-Resendiz2*,Kurt M. Dreckmann2 & Abel Sentíes2
1Estudiante de Biología, Facultad de Ciencias, Universidad Nacional Autónoma de México (UNAM). Coyoacán, C04510, Apartado Postal 70–474, Ciudad de México, México.
2Departamento de Hidrobiología, Universidad Autónoma Metropolitana - Iztapalapa. (UAM-I). 09340, Apartado postal 55-535, Ciudad de México, México.
*Email:mlnr@ciencias.unam.mx
Rosas Ortíz, J.F., M.L. Núñez-Resendiz, K.M. Dreckmann & A. Sentíes. 2019. Diversidad de Halymeniaceae (Halymeniales, Rhodophyta) en México. Cymbella 5 (2-3): 135-146
Resumen
La familia Halymeniaceae está conformada por 38 géneros y 349 especies taxonómicamente válidas, ampliamente distribuidas en todo el mundo. Estructuralmente se caracterizan por una construcción multiaxial y reproducción sexual que involucra ramas carpogoniales, células auxiliares y tetrasporangios cruzados. Desde 1940, de las 349 especies actualmente en uso para la familia, 52 especies y una variedad han sido registradas para México, lo que representa el 15% de la diversidad de la familia a nivel mundial, 42 especies (12 %) y una variedad han sido registradas en los estados del Pacífico y 12 especies (3 %) en los estados del Atlántico. De los géneros que se distribuyen en México, Cryptonemia, Dermocorynus, Grateloupia y Halymenia han sido registrados en ambos océanos, mientras que Carpopeltis, Norrisia, Pachymenia y Prionitis son exclusivos del Pacífico mexicano y Codiophyllum del Atlántico mexicano. Cryptonemia obovata y Grateloupia filicina son especies comunes en ambos océanos. Finalmente, los estados con mayor número de registros fueron Baja California en el Pacífico y Tamaulipas, Veracruz y Quintana Roo en el Atlántico. A pesar de que esta familia ha sido muy poco estudiada en México, se espera que la aplicación de herramientas moleculares para su estudio incremente de manera significativa la diversidad alfa en las costas mexicanas.
Palabras clave: Atlántico mexicano, distribución, Pacífico mexicano, riqueza, sinónimos nomenclaturales.Abstract
The family Halymeniaceae are integrated by 38 genera and 349 taxonomically valid species widely distributed around the world. Structurally are characterised by a multiaxial thallus and sexual reproduction that involves carpogonial branches, auxiliary cells, and cruciately tetrasporangia. Since 1940, of the 344 species currently in use for the family, 52 species and a variety have been recorded for Mexico, representing 15% of the worldwide diversity in the family, 42 species (12%) and a variety have been recorded in the Pacific states and 12 species (3%) in the Atlantic states. From the genera that are distributed in Mexico, Cryptonemia, Dermocorynus, Grateloupia and Halymenia have been recorded in both oceans, while Carpopeltis, Norrisia, Pachymenia and Prionitis are exclusive to the Mexican Pacific and Codiophyllum to the Mexican Atlantic. Cryptonemia obovata and Grateloupia filicina are common species in both oceans. Finally, the states with the highest number of records were Baja California in the Pacific and Tamaulipas, Veracruz and Quintana Roo in the Atlantic. Although this family has been very poorly studied in Mexico, the application of molecular tools for their study is expected to significantly increase the alpha diversity in the Mexican coasts.
Keywords: distribution, Mexican Atlantic, Mexican Pacific, nomenclatural synonyms, richness.Introducción.
El orden Halymeniales es uno de los más diversos y mejor estudiados en las algas rojas, comprende cerca de 354 especies distribuidas en dos familias, Tsengiaceae (Saundersand & Kraft 2002) y Halymeniaceae (Womersley & Lewis 1994), de las cuáles esta última, además de ser la más antigua y dar nombre al orden, contiene al mayor número de especies. Actualmente, Halymeniaceae está conformada por 38 géneros y 349 especies taxonómicamente válidas (Guiry & Guiry 2020), ampliamente distribuidas en ambientes templados y tropicales en los océanos de todo el mundo (Azevedo et al. 2016; Gabrielson 2008; García-Jiménez et al. 2008; Hernández-Kantún et al. 2012). Sus representantes son muy diversos morfológicamente, presentan talos lubricados que pueden ser aplanados, complanados o cilíndricos, de formas acintadas, foliosas, esponjosas o arbustivas (Fig. 1), erectos o rastreros o decumbentes, poco a muy ramificados, de 10-60 cm de talla (Athanasiadis 2016; Womersley y Lewis 1994). Sin embargo, todas ellas se caracterizan por presentar una estructura multiaxial, médula filamentosa con numerosos pit-connections secundarios y corteza pseudoparenquimatosa; pit-plugs delimitados por una membrana en ambas superficies; ramas carpogoniales de 2 a 4 células, dirigidas hacia el exterior; filamentos conectivos de post-fertilización surgiendo directamente del carpogonio, ramificados y septados; células auxiliares en un sistema de rama cortical separado; carposporofito multilobulado, la mayoría de las células formando carposporangios; tetrasporangios decusada o cruciadamente divididos (Kawaguchi 1991; Womersley y Lewis 1994). Los caracteres reproductivos femeninos son, sin embargo, los que tradicionalmente han sido utilizados para delimitar a las especies en varios géneros. El sistema reproductivo femenino en Halymeniaceae consiste en un ámpula de rama carpogonial separada de un ámpula generadora de la célula auxiliar, ambas participantes en la fecundación (Athanasiadis 2016; Chiang 1970; Huisman y DeClerck 2018; Womersley y Lewis 1994). A la fecha, han sido descritos ocho tipos morfológicos de ámpulas para la reproducción de las especies de la familia (Chiang 1970; D’Archino et al. 2014).
Por otro lado, varias especies de la familia poseen importancia económica debido a que, en algunas de ellas, como Cryptonemia crenulata (J. Agardh) J. Agardh, los carragenanos presentes en su pared celular pueden ser utilizados para la industria (Zablackis & Perez. 1990; Zibetti et al. 2005), mientras que otras especies, poseen actividad antitumoral o antibacterial como resultado de su metabolismo secundario (García-Bueno et al. 2014; Sen et al. 2002).
Con el empleo de marcadores moleculares en los estudios de sistemática filogenética en especies de algas rojas, se ha reescrito prácticamente la clasificación biológica de ese grupo (Cianciola et al. 2010; Rodríguez-Prieto et al. 2018) y la familia Halymeniaceae es uno de los grupos en donde se han realizado grandes cambios taxonómicos a diferentes niveles jerárquicos. Entre ellos, la descripción de nuevas especies (Azevedo et al. 2016; Bolton et al. 2016; Cao et al. 2016a, b; Kawaguchi et al. 2003; Lee & Kim 2019; Lin et al. 2008; Liu et al. 2014; Mateo-Cid et al. 2005; Núñez-Resendiz et al. 2020; Schneider et al. 2018; Tan et al. 2015, 2018; Yang & Kim 2014; Zhao et al. 2012), varios géneros han sido parcial o totalmente segregados (Kawaguchi et al. 2004; Lin & Liang 2011), o fusionados (Kawaguchi et al. 2002; Rodríguez-Prieto et al. 2018; Russell et al. 2009), diversos géneros o especies que fueron puestos en sinonimia han sido reestablecidos (DeClerck et al. 2005a, b; Faye et al. 2004; Gabrielson 2008; LeGall et al. 2018; Lou et al. 2019; Tan & Lim 2018; Wang et al. 2000; Wilkes et al. 2005), a partir de otras especies se han creado categorías superiores (Calderon et al. 2016; D’Archino et al. 2014; Hommersand et al. 2010; Manghisi et al. 2014; Rodríguez-Prieto et al. 2018) y la distribución de otras especies ha sido acotada o han sido calificadas como invasoras para algunas regiones (D’Archino et al. 2007; García-Jiménez et al. 2008; Gavio & Fredericq 2002; Hernández-Kantún et al. 2012; Marston & Villalard-Bohnsack 2002; Montes et al. 2016; Verlaque et al. 2005).
A pesar de su diversidad y abundancia en las costas mexicanas y de que en otras partes del mundo existen trabajos monográficos completos de varios géneros de Halymeniaceae, en México sólo se les menciona en listados florísticos y catálogos con registros de especies (Dreckmann 1998; Godínez-Ortega et al. 2019; Mateo-Cid et al. 2005; Núñez-Resendiz et al. 2019; Ortega et al. 2001; Pedroche et al. 2019). Sin embargo, estos trabajos constituyen la base del conocimiento de esta familia en las costas mexicanas. Para la costa del Pacífico de México destacan los trabajos de Dawson (1944a, b, 1961), Mateo-Cid et al. (2005); Norris et al. (2019), Pedroche et al. (2019) y Setchell & Gardner (1924). Para la costa Atlántica de México destacan los trabajos de Callejas-Jiménez et al. (2005), Dreckmann (1998), Godínez-Ortega et al. (2019), Núñez-Resendiz et al. (2020), Ortega et al. (2001), Sentíes & Dreckmann (2013), Taylor (1960) y Wynne (2017).
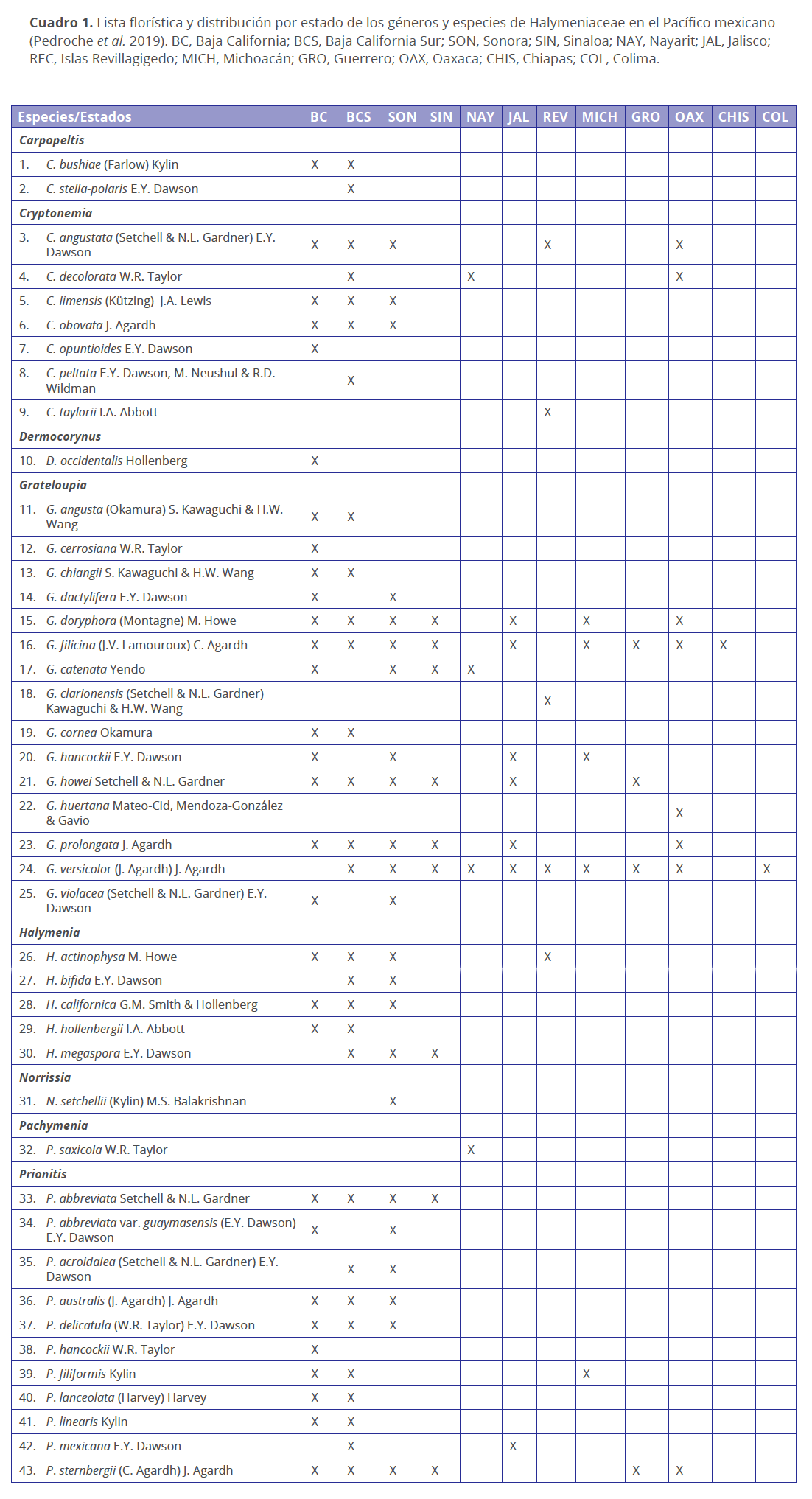
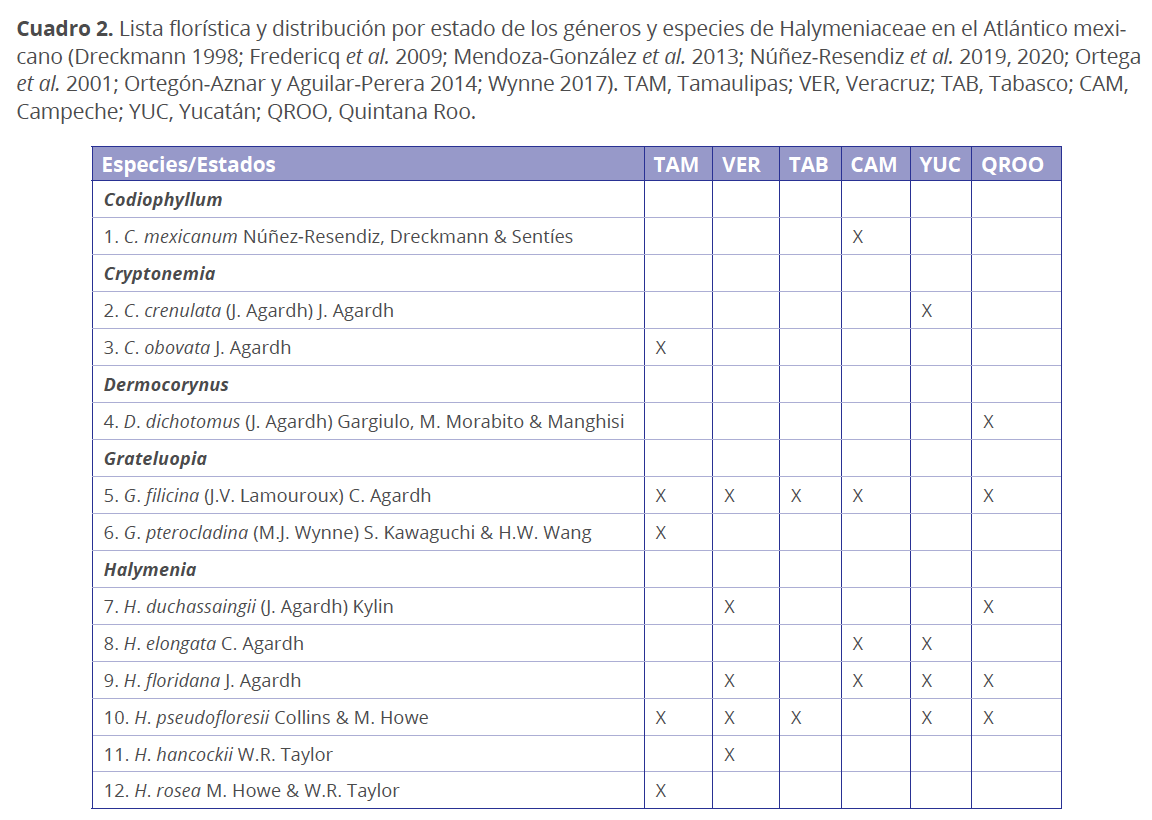
Diversidad.
Desde la circunscripción de la familia Halymeniaceae por Bory en 1828 se han registrado cerca de 758 nombres de especies en aproximadamente 45 géneros, 414 de los cuales son actualmente sinónimos nomenclaturales, dejando ocho géneros en desuso (Abbottia Perestenko, Cyrtymenia F. Schmitz, Dactylymenia J. Agardh, Dictyophora F. Schmitz, Halymeniopsis Yamada, Sinkoraena H.-B. Lee, J.A. Lewis, G.T. Kraft & I.K. Lee, Sinotubimorpha W.-X. Li & Z.-F. Ding). De los 38 géneros válidos actualmente para la familia, nueve se distribuyen en los litorales mexicanos (Cuadros 1 y 2), lo que representa el 24 % de la diversidad de la familia a nivel de género en el mundo. De las 349 especies actualmente en uso para la familia (Guiry & Guiry 2020), 52 especies y una variedad han sido registradas para México, lo que representa el 15 % de la diversidad de las especies de la familia a nivel mundial. De esta diversidad, 42 especies (12 %) y una variedad han sido registradas en los estados del Pacífico (Cuadro 1) y 12 especies (3 %) en los estados del Atlántico (Cuadro 2). Dado que la diversidad actual de macroalgas marinas mexicanas de la división Rhodophyta se cuenta en aproximadamente 1855 nombres de especies para el Pacífico y 900 nombres de especies para el Atlántico (Pedroche & Sentíes 2003; Wynne 2017), se estima que las 42 especies registradas para el Pacífico representan el 2.3 % de la diversidad a nivel nacional, mientras que las 12 especies registradas para el Golfo de México y Caribe mexicano representan el 1.3 %. De los géneros que se distribuyen en México, Cryptonemia J. Agardh, Dermocorynus P. Crouan & H. Crouan, Grateloupia C. Agardh y Halymenia C. Agardh se comparten en ambos océanos. Los géneros Carpopeltis F. Schmitz, Norrisia Balakrishnan, Pachymenia J. Agardh y Prionitis J. Agardh son exclusivos del Pacífico mexicano, mientras el género Codiophyllum J.E. Gray es exclusivo del Atlántico mexicano. Además, Cryptonemia obovata J. Agardh y Grateloupia filicina (J.V. Lamouroux) C. Agardh son especies comunes en ambos océanos.
Respecto a su distribución en los litorales mexicanos, las costas con mayor número de géneros y especies (g/e) registrados en el Pacífico son: Baja California (6/29 y una variedad), Baja California Sur (5/29) y Sonora (5/22 y una variedad), seguido por Sinaloa (3/9), Oaxaca (3/8), Jalisco (2/7), Islas Revillagigedo (3/5), Michoacán (2/5), Guerrero (2/4), Nayarit (3/4); y finalmente, los estados con menos número de registros son Colima y Chiapas (1/1) (Cuadro 1). En cuanto a las costas del Atlántico, los estados con mayor número de géneros y especies registradas son: Tamaulipas (3/5), Quintana Roo (3/5) y Veracruz (2/5), seguido de Campeche (2/4), Yucatán (2/4) y Tabasco (2/2), donde se presenta la menor diversidad (Cuadro 2). En general, los estados con la mayor riqueza taxonómica pertenecen a la Penínsulas de Baja California en el Pacífico y a Tamaulipas, Veracruz y Quintana Roo en el Atlántico. Sin embargo, la diversidad del Pacífico podría deberse, además de a las condiciones de temperatura templada que son propicias para el establecimiento de la mayoría de las especies de la familia, a que en estos estados laboran un mayor número de especialistas, mientras que en los estados del Atlántico y en aquellos con menos número de registros, podría deberse a las condiciones fisiográficas y a las temperaturas de los sitios donde crecen estas especies, que al ser climas tropicales, su establecimiento puede verse limitado o impedido. Por otro lado, la poca diversidad en el Atlántico también puede deberse tanto a que, cuando crecen en estos ambientes tropicales, crecen a grandes profundidades (por debajo de los 20 m), limitando el muestreo a técnicas especializadas de buceo, como a la falta de experiencia en el grupo, ya que se trata de especies monótonas, es decir poco variables morfológicamente, que fácilmente pueden ser identificadas de manera errónea.
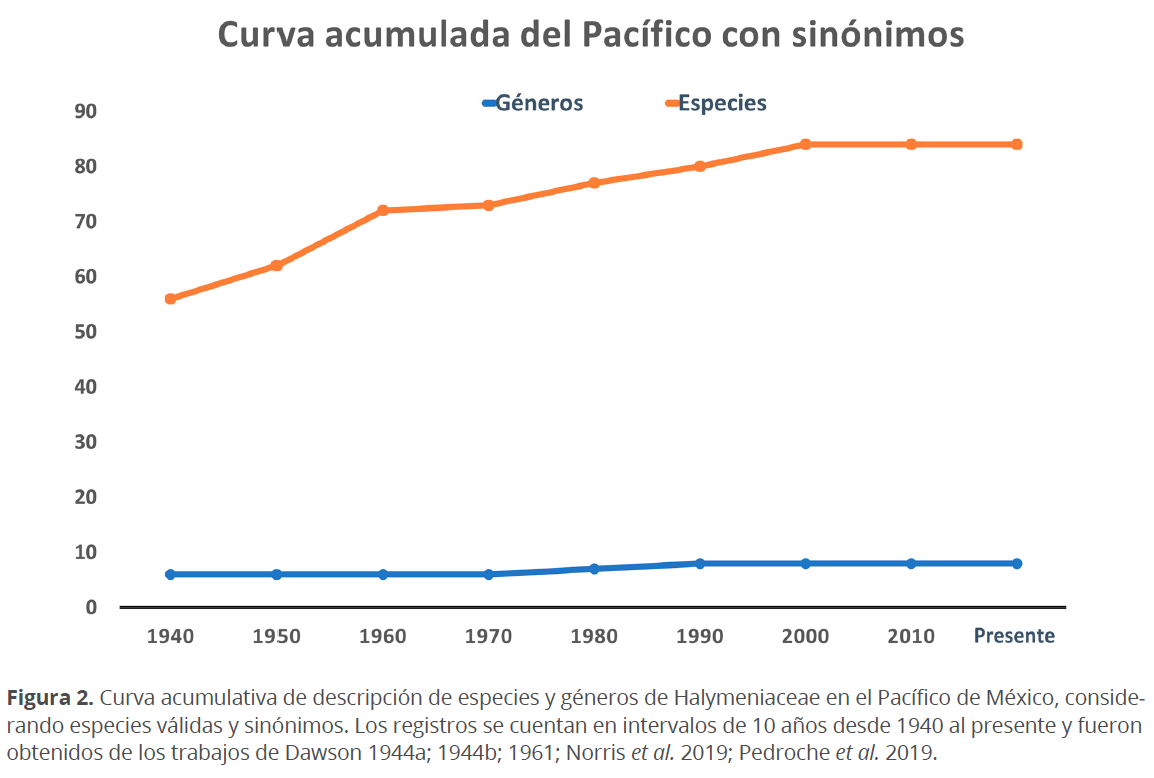
Curva de acumulación de especies. Los primeros registros de especies de Halymeniaceae para la costa del Pacífico de México, a principios del siglo XX, fueron Grateloupia howei, G. prolongata, G. violaceae, Prionitis acroidalea (como G. acroidalea) y P. abbreviata (Setchell & Gardner 1924). Desde entonces hasta los 40’s, cuando aparecen los trabajos de Dawson (1944a, b y posteriores) con nuevos registros de la familia para la zona, se habían añadido ya a la ficoflora de la región 50 nombres de especies de Halymeniaceae distribuidos en 6 géneros. Desde esta década hasta 1980, el número de nombres de especies añadidas a la flora del Pacífico se mantuvo siempre en incremento, tal como lo muestra la gráfica acumulada en la Fig. 2 (que considera nombres que actualmente son sinónimos nomenclaturales o han sido transferidos a otras familias), contabilizando para entonces 70 nombres de especies distribuidos en 7 géneros. Desde entonces al presente, los estudios florísticos en que se incluyan especies de Halymeniaceae para la región han sido escasos, ya que en los últimos 40 años únicamente se han añadido 6 nombres de especies y un género (Fig. 2). Considerando únicamente nombres taxonómicamente válidos en la actualidad (Guiry & Guiry 2020), la diversidad de Halymeniaceae en las costas del Pacífico mexicano, se estima en un total de 43 nombres que corresponden con 42 especies y una variedad, distribuidos en 8 géneros (Cuadro 1). En la gráfica de la Fig. 2 (total de nombres considerando sinónimos), se observa también que el incremento de especies es superior, en una proporción aproximada de 9:1, al número de nombres genéricos.
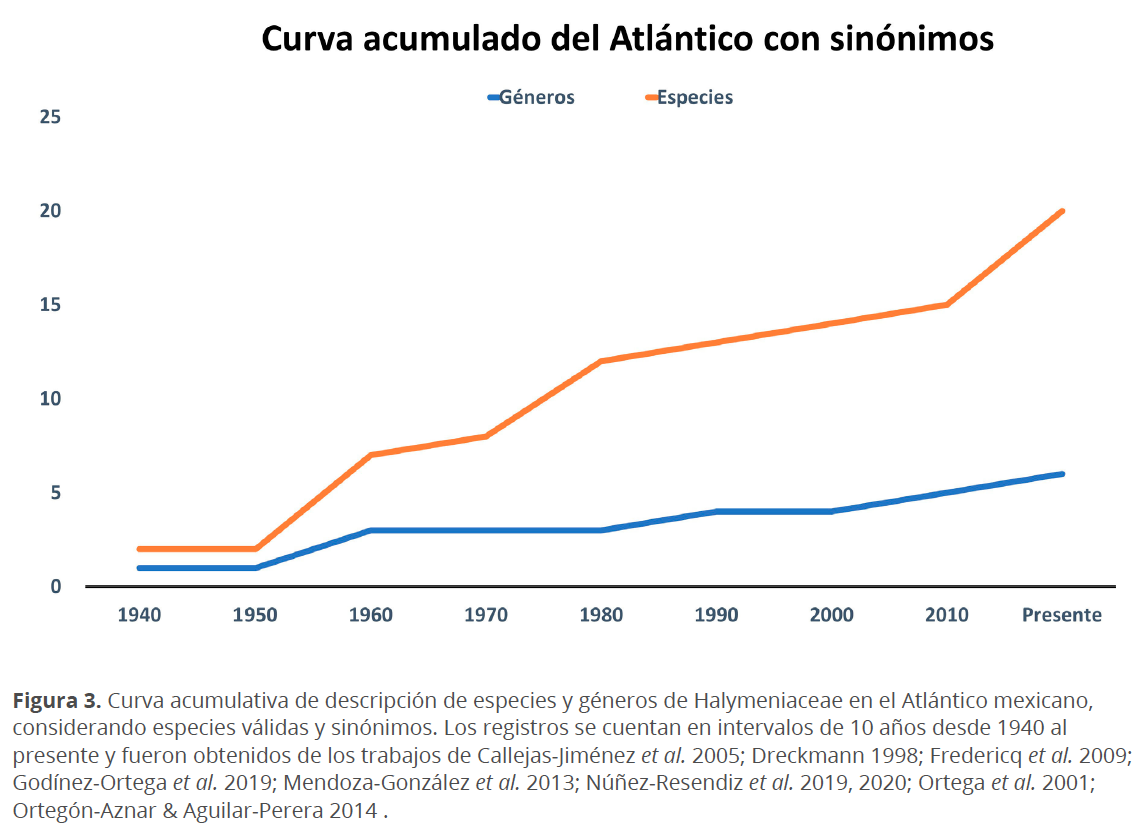
Para la costa Atlántica mexicana, en 1846 Liebman hizo el primer registro de esta familia (Grateloupia filicina). Sin embargo, en esta región, las especies no han sido ampliamente estudiadas en comparación con el Pacífico, ya que desde 1846 a 1950, la curva se mantiene constante, añadiéndose únicamente 2 nombres de especies y un género en casi un siglo. Entre 1960-1990 se añadieron 13 nombres más de especies y 4 géneros, como se muestra en la gráfica acumulada en la Fig. 3 (que considera nombres que actualmente son sinónimos nomenclaturales o han sido transferidos a otras familias). Desde 1990 al presente, se ha añadido cada década una especie y sólo un género, y en 2019, 2 especies y un género (Godínez-Ortega et al. 2019; Núñez-Resendiz et al. 2020), lo que da un total de 20 especies distribuidas en 6 géneros (Fig. 3). Considerando únicamente nombres taxonómicamente válidos en la actualidad (Guiry & Guiry 2020), la diversidad de Halymeniaceae en las costas del Atlántico mexicano, se estima en un total de 12 especies distribuidas en 5 géneros (Cuadro 2). En la gráfica de la Fig. 3 (total de nombres considerando sinónimos), se observa también que el incremento de especies es superior, en una proporción aproximada de 3:1, al incremento en nombres genéricos.
Expectativa taxonómica. Las filogenias actuales basadas en marcadores moleculares han introducido numerosos y notables cambios a la taxonomía de la familia Halymeniaceae, reclasificando prácticamente a todas las especies (Rodríguez-Prieto et al. 2018; 2019). Por ejemplo, muchos géneros han mostrado ser parafiléticos (Huisman et al. 2011; Schneider et al. 2018), lo que ha resultado en un considerable incremento a la diversidad alfa al interior de la familia desde 2001 al presente. En México, sólo se ha realizado un estudio filogenético en esta familia, resultando en la descripción de una nueva especie para el Atlántico (Núñez-Resendiz et al. 2020). Siguiendo esta tendencia, se considera que la aplicación de marcadores moleculares en la identificación taxonómica de los especímenes mexicanos de Halymeniaceae, arrojará novedades taxonómicas que indudablemente redundarán en un incremento significativo de la biodiversidad algal conocida para México, ya que, a pesar de su abundancia en las costas mexicanas, el conocimiento de la familia Halymeniaceae es muy limitado. Como lo refleja el presente análisis, han transcurrido entre 30 y 40 años en que las adiciones a la flora mexicana en esta familia han sido prácticamente nulas. A pesar de que se les sigue registrando en los estudios florísticos presentes, se siguen registrando las mismas especies ya conocidas. Sin embargo, ninguno de esos registros, excepto Codiophyllum mexicanum que además de ser una nueva especie constituye un nuevo registro genérico para todo el litoral Atlántico (Núñez-Resendiz et al. 2020), han sido estudiados molecularmente. Incluso, muchas de las especies registradas en los litorales mexicanos al presente, ya han sido restringidas, molecularmente, a otras regiones del Atlántico norte o Indo-Pacífico (Schneider et al. 2018), lo que revela la necesidad de ahondar en la revisión de la diversidad de Halymeniaceae para México desde un enfoque molecular.
AGRADECIMIENTOS.
Este trabajo incluye la revisión bibliográfica del proyecto de investigación “Diversidad y distribución de las especies de la familia Halymeniaceae (Halymeniales, Rhodophyta) en la Península de Yucatán” con el que el primer autor optará por la modalidad de titulación de apoyo a la investigación, para obtener el título de Licenciado en Biología, el cuál es financiado por los proyectos: (UAMI-CBS2019-2022 sesión 15.18 281118 y UAMI-CA- 117, PRODEP).
REFERENCIAS
Athanasiadis, A. 2016. Phycologia Europaea Rhodophyta. Publicado por el autor. Gothenburg.
Azevedo, C.A.A., V. Cassano & M.C. Oliveira. 2016. Phylogenetic relationships among Halymenia (Halymeniaceae, Rhodophyta) species on the Brazilian coast with description of Halymenia cearensis sp. nov. Phytotaxa 280: 241-258.
Bolton, J.J., O. De Clerck, C.M. Francis, F. Siyanga-Tembo & R.J. Anderson. 2016. Two newly discovered Grateloupia (Halymeniaceae, Rhodophyta) species on aquaculture rafts on the west coast of South Africa, including the widely introduced Grateloupia turuturu. Phycologia 55: 659-664.
Calderon, M.S., G.H. Boo & S.M. Boo. 2016. Corrigendum: ‘Morphology and phylogeny of Ramirezia osornoensis gen. & sp. nov. and Phyllymenia acletoi sp. nov. (Halymeniales, Rhodophyta) from South America’. Phycologia 55: 610.
Callejas-Jiménez, M.E., A. Sentíes & K.M. Dreckmann. 2005. Macroalgas bentónicas de Puerto Real, Faro Santa Rosalía y Playa Preciosa, Campeche, México, con algunas consideraciones florísticas y ecológicas para el estado. Hidrobiológica 15: 89-96.
Cao, C., M. Liu, S. Guo, D. Zhao, R. Luan & H. Wang. 2016a. Grateloupia ramosa Wang & Luan sp. nov. (Halymeniaceae, Rhodophyta), a new species from China based on morphological evidence and comparative rbcL sequences. Chinese Journal of Oceanology and Limnology 34: 283-294.
Cao, C.C., Y.Z. Li, & H.W. Wang. 2016b. Morphological observation, life history and rbcL gene sequence analysis of a new species, Grateloupia variata sp. nov. (Halymeniaceae, Rhodophyta) from Qingdao, China. Marine Biology Research 12: 443-453.
Chiang, Y.M. 1970. Morphological studies of red algae of the family Cryptonemiaceae. University of California Publications in Botany 58: 1–95.
Cianciola, E., T. Popolizio, C. Schneider & C. Lane. 2010. Using molecular-assisted alpha taxonomy to better understand red algal biodiversity in Bermuda. Diversity 2: 946–958.
D’Archino, R., W.A. Nelson & G.C. Zuccarello. 2007. Invasive marine red alga introduced to New Zealand waters: first record of Grateloupia turuturu (Halymeniaceae, Rhodophyta). New Zealand Journal of Marine and Freshwater Research 41: 35-42.
D’Archino, R., W.A. Nelson, & G.C. Zuccarello. 2014. Amalthea and Galene, two new genera of Halymeniaceae (Rhodophyta) from New Zealand. Botanica Marina 57: 185-201.
Dawson, E.Y. 1944a. Botanizing in an open boat. Journal of the New York Botanical Garden. 45:126-132.
Dawson, E.Y. 1944b. The marine Algae of the Gulf of California. Allan Hancock Pacific Expedition 3: 189-453.
Dawson, E.Y. 1961. Marine red algae of Pacific Mexico. Part 4: Gigartinales. Pacific Naturalist 2: 191-343.
De Clerck, O., B. Gavio, S. Fredericq, I. Bárbara & E. Coppejans. 2005a. Systematics of Grateloupia filicina (Halymeniaceae, Rhodophyta), based on rbcL sequence analyses and morphological evidence, including the reinstatement of G. minima and the description of G. capensis sp. nov. Journal of Phycology 41: 391-410.
De Clerck, O., B. Gavio, S. Fredericq, E. Cocquyt & E. Coppejans. 2005b. Systematic reassessment of the red algal genus Phyllymenia (Halymeniaceae, Rhodophyta). European Journal of Phycology 40: 169-178.
Dreckmann, K.M. 1998. Clasificación y nomenclatura de las macroalgas marinas bentónicas del Atlántico mexicano. CONABIO. Universidad Autónoma Metropolitana Unidad Iztapalapa. México.
Faye, E.T., H.W. Wang, S. Kawaguchi, S. Shimada & M. Masuda. 2004. Reinstatement of Grateloupia subpectinata (Rhodophyta, Halymeniaceae) based on morphology and rbcL sequences. Phycological Research 52: 59-68.
Fredericq, S., T.O. Cho, S.A. Earle, C.F. Gurgel, D.M. Krayesky, L.E. Mateo-Cid, A.C. Mendoza-González, J.N. Norris & A.M. Suárez. 2009. Seaweeds of the Gulf of Mexico. In: D.L. Felder & D.K. Camp. Eds. Gulf of Mexico – Origins, Waters, and Biota. Biodiversity Texas A&M Press, Corpus Christi. pp: 187–259.
Gabrielson, P.W. 2008. Molecular sequencing of Northeast Pacific type material reveals two earlier names for Prionitis lyallii, Prionitis jubata and Prionitis sternbergii, with brief comments on Grateloupia versicolor (Halymeniaceae, Rhodophyta). Phycologia 47: 89-97.
García-Bueno, N., P. Decottignies, V. Turpin, J. Dumay, C. Paillard, V. Stiger-Pouvreau, N. Kervarec, I.F. Pouchus, A.A. Marín-Atucha & J. Fleurence. 2014. Seasonal antibacterial activity of two red seaweeds, Palmaria palmata and Grateloupia turuturu, on European abalone pathogen Vibrio harveyi. Aquatic Living Resources 27: 83-89.
García-Jiménez, P.L., P.J.L. Geraldino, S.M. Ming Boo & R.R. Robaina. 2008. Red alga Grateloupia imbricata (Halymeniaceae), a species introduced into the Canary Islands. Phycological Research 56: 166-171.
Gavio, B. & S. Fredericq. 2002. Grateloupia turuturu (Halymeniaceae, Rhodophyta) is the correct name of the non-native species in the Atlantic known as Grateloupia doryphora. European Journal of Phycology 37: 349-360.
Godínez-Ortega, J.L., P. Ramírez-García, A. Granados-Barba & M.J. Wynne. 2019. New records of subtidal benthic marine algae from the state of Veracruz, southern Gulf of Mexico. Revista Mexicana de Biodiversidad 90: e902719.
Guiry, M.D. & G.M. Guiry. 2020. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org. (consultado el 5 de enero 2020).
Hernández-Kantún, J.J., A.R. Sherwood, R. Riosmena-Rodriguez, J.M. Huisman & O. De Clerck. 2012. Branched Halymenia species (Halymeniaceae, Rhodophyta) in the Indo-Pacific region, including descriptions of Halymenia hawaiiana sp. nov. and H. tondoana sp. nov. European Journal of Phycology 47: 421-432.
Hommersand, M.H., G.L. Leister, M.E. Ramírez, P.W. Gabrielson & W.A. Nelson. 2010. A morphological and phylogenetic study of Glaphyrosiphon gen. nov. (Halymeniaceae, Rhodophyta) based on Grateloupia intestinalis with descriptions of two new species: Glaphyrosiphon lindauri from New Zealand and Glaphyrosiphon chilensis from Chile. Phycologia 49: 554-573.
Huisman, J.M. & O. De Clerck. 2018. Halymeniaceae. In: J.M. Huisman. Ed. Algae of Australia. Marine benthic algae of north-western Australia, 2. Red algae, CSIRO Publishing, Canberra, pp. 279-294.
Huisman, J.M., O. De Clerck, W.F. Prud’homme Van Reine & M.A. Borowitzka 2011. Spongloea, a new genus of red algae based on Thamnoclonium sect. Nematophorae Weber-van Bosse (Halymeniales). European Journal of Phycology 46: 1-15.
Kawaguchi, S. 1991. Taxonomic notes on the Halymeniaceae (Rhodophyta) from Japan, I. Japanese Journal of Phycology 39: 329-336.
Kawaguchi, S., S. Shimada, H.W. Wang & M. Masuda. 2004. The new genus Yonagunia Kawaguchi & Masuda (Halymeniaceae, Rhodophyta), based on Y. tenuifolia Kawaguchi & Masuda sp. nov. from southern Japan and including Y. formosana (Okamura) Kawaguchi & Masuda comb. nov. from southeast Asia. Journal of Phycology 40: 180-192.
Kawaguchi, S., S. Shimada, H.W. Wang, E.J. Faye & M. Masuda, M. 2003. Polyopes tosaenis Kawaguchi & Masuda, sp. nov. (Halymeniaceae, Rhodophyta) from Japan. European Journal of Phycology 38: 315-324.
Kawaguchi, S., H.W. Wang, T. Horiguchi, J.A. Lewis & M. Masuda. 2002. Rejection of Sinkoraena and transfer of some species of Carpopeltis and Sinkoraena to Polyopes (Rhodophyta, Halymeniaceae). Phycologia 41: 619-635.
Le Gall, L., D. Gey & A. Vergés. 2018. Insights into the rare Mediterranean endemic Kallymenia spathulata: DNA phylogenies resolve this species as Halymeniaceae (Halymeniales) rather than Kallymeniaceae (Gigartinales), with the proposal of Felicinia spathulata comb. nov. Cryptogamie, Algologie 39: 339-347.
Lee, H.W. & M.S. Kim. 2019. Female reproductive structures define the novel genus, Nesoia (Halymeniaceae, Rhodophyta). European Journal of Phycology 54: 66-77.
Lin, S. M. & H.Y. Liang. 2011. Grateloupia huangiae (Halymeniaceae, Rhodophyta), a new species from Taiwan previously confused with Polyopes lancifolius, with emphasis on the development of the auxiliary-cell ampullae. Phycologia 50: 232-240.
Lin, S.-M., H.Y. Liang & M.H. Hommersand. 2008. Two types of auxiliary cell ampullae in Grateloupia (Halymeniaceae) including G. taiwanensis sp. nov. and G. orientalis sp. nov. from Taiwan based on rbcL gene sequence analysis and cystocarp development. Journal of Phycology 44: 196-214.
Liu, M., H.W. Wang & R.X. Luan. 2014. Morphological observation and rbcL sequence analysis of a new species from China, Grateloupia boaoensis Wang et Luan sp. nov. (Halymeniaceae, Rhodophyta). Acta Hydrobiologia Sinica 38: 938-944.
Lou, Y., P. Yi, X.W. Song & H.W. Wang. 2019. Grateloupia serra sp. nov. H. W. Wang & Y. Lou (Halymeniaceae, Rhodophyta): a new species previously confused with Grateloupia asiatica in China. Marine Biology Research 15: 1-12.
Manghisi, A., L. Le Gall, M.A. Ribera, C. Bonillo, G.M. Gargiulio & M. Morabito 2014. The Mediterranean endemic new genus Felicina (Halymeniales, Rhodophyta) recognized by a morphological and phylogenetic integrative approach. Cryptogamie, Algologie 35: 221–243.
Marston, M. & M. Villalard-Bohnsack. 2002. Genetic variability and potential sources of Grateloupia doryphora (Halymeniaceae, Rhodophyta), an invasive species in Rhode Island waters (USA). Journal of Phycology 38: 649-658.
Mateo-Cid, L.E., A.C. Mendoza-González, B. Gavio & S. Fredericq. 2005. Grateloupia huertana sp. nov. (Halymeniaceae, Rhodophyta), a peculiar new prostrate species from tropical Pacific Mexico. Phycologia 44: 4-16.
Mendoza-González, C.A., L.E. Mateo-Cid & P.H. López-Garrido. Algas marinas bentónicas asociadas a pecios y otras estructuras submareales de Campeche, México. Acta Botanica Venezuelica 36: 119-140.
Miller, K.A., J.R. Hughey & P.W. Gabrielson. 2009. First report of the Japanese species Grateloupia lanceolata (Halymeniaceae, Rhodophyta) from California, USA. Phycological Research 57: 238-241.
Montes, M., J.M Rico, E. García-Vázquez & Y.J. Borrell. 2016. Morphological and molecular methods reveal the Asian alga Grateloupia imbricata (Halymeniaceae) occurs on Cantabrian Sea shores (Bay of Biscay). Phycologia 55: 365-370.
Norris, J.N., L.E. Aguilar-Rosas & F.F. Pedroche. 2019. Conspectus of the benthic marine algae of the Gulf of California: Rhodophyta, Phaeophyceae, and Chlorophyta. Smithsonian Institution Scholarly Press, Washington.
Núñez-Resendiz, M.L., K.M. Dreckmann, A. Sentíes, M.J. Wynne & H.P. León-Tejera. 2019. Marine red algae (Rhodophyta) of economic use in the algal drifts from the Yucatan Peninsula, Mexico. Phytotaxa 387: 219–240.
Núñez-Resendiz, M.L., K.M. Dreckmann, M.J. Wynne & A. Sentíes. 2020. Codiophyllum mexicanum sp. nov. (Halymeniaceae, Rhodophyta), first record of a stalked red alga associated with sponges in the Western Atlantic. Phycologia 59: 89-98.
Ortega, M.M., J.L. Godínez & G.G. Solórzano. 2001. Catálogo de las algas bénticas de las costas Mexicanas del Golfo de México y Mar Caribe. Cuadernos del Instituto de Biología (UNAM) 34: 1-594.
Ortegón-Aznar, I. & A. Aguilar-Perera. 2014. Distribución de las macroalgas en áreas naturales protegidas de la costa norte de la Península de Yucatán, México. Revista de investigaciones marinas 34: 1-12.
Pedroche, F.F. & A. Sentíes. 2003. Ficología marina mexicana. Diversidad y problemática actual. Hidrobiológica 13: 23–32.
Pedroche, F.F., P.C. Silva, L.E. Aguilar-Rosas & R. Aguilar-Rosas. 2019. Catálogo de las Algas Marinas Bentónicas del Pacífico de México. III. Rhodophyta. Universidad Autónoma Metropolitana. Ciudad de México.
Rodríguez-Prieto, C., O. De Clerck, J.M. Huisman & S.M. Lin. 2018. Systematics of the red algal genus Halymenia (Halymeniaceae, Rhodophyta): characterization of the generitype H. floresii and description of Neofolia rosea gen. et sp. nov. European Journal of Phycology 53: 520-536.
Rodríguez-Prieto, C., O. De Clerck, J.M. Huisman & S.M. Lin. 2019. Characterisation of Nesoia latifolia (Halymeniaceae, Rhodophyta) from Europe with emphasis on cystocarp development and description of Nesoia mediterranea sp. nov. Phycologia 58: 393-404.
Russell, L.K., C.L. Hurd, W.A. Nelson & J.E. Broom. 2009. An examination of Pachymenia and Aeodes (Halymeniaceae, Rhodophyta) in New Zealand and the transfer of two species of Aeodes in South Africa to Pachymenia. Journal of Phycology 45: 1389-1399.
Saunders, G.W. & G.T. Kraft. 2002. Two new australian specied of Predaea (Nemastomateceae, Rhodophyta) with taxonomic recommendations for an emended Halymeniales. Journal of Phycology 38: 1245-1260.
Schneider, C.W., C.E. Lane & G.W. Saunders. 2018. A revision of the genus Cryptonemia (Halymeniaceae, Rhodophyta) in Bermuda, western Atlantic Ocean, including five new species and C. bermudensis (Collins & M. Howe) comb. nov. European Journal of Phycology 53: 350-368.
Sen, A.K., A.K. Das, K.K. Sarkar, A.K. Siddhanta, R. Takano, K. Kamei & S. Hara. 2002. An Agaroid-Carrageenan hybrid type backbone structure for the antithrombotic sulfated polysaccharide from Grateloupia indica Boergensen (Halymeniales, Rhodophyta). Botanica Marina 45: 331-338.
Sentíes, A. & K.M. Dreckmann. 2013. Lista actualizada de las macroalgas de Tabasco, México. Acta Botanica Venezuelica 36: 109-117.
Setchell, W.A. & N. L. Gardner. 1924. New Marine algae from the Gulf of California. Proceedings California Academy of Sciences 12: 695-949.
Sham El-Din, N.G. & H.M. Aboul-Ela, 2017. The new record of Grateloupia doryphora (Halymeniaceae, Rhodophyta) alga in the Egyptian Mediterranean Sea recognized by morphological and molecular integrative approach. Plant Cell Biotechnology and Molecular Biology 18: 432-449.
Tan, P.L. & P.E. Lim. 2018. Validation of Halymenia malaysiana (Halymeniaceae, Rhodophyta). Notulae Algarum 46: 1.
Tan, P.L., P.E. Lim, S.M. Lin, S.M. Phang, G.A. Draisma & L.M. Liao. 2015. Foliose Halymenia species (Halymeniaceae, Rhodophyta) from Southeast Asia, including a new species, Halymenia malaysiana sp. nov. Botanica Marina 58: 203-217.
Tan, P.L., P.E. Lim, S.M. Lin & S.M. Phang. 2018. Halymenia johorensis sp. nov. (Halymeniaceae, Rhodophyta), a new foliose red algal species from Malaysia. Journal of Applied Phycology 30: 187-195.
Taylor, W.R. 1960. Marine algae of the eastern tropical and subtropical coast of the Americas. University of Michigan Press, Ann Harbor.
Verlaque, M., P.M. Brannock, T. Komatsu, T., M. Villalard-Bohnsack & M. Marston. 2005. The genus Grateloupia C. Agardh (Halymeniaceae, Rhodophyta) in the Thau Lagoon (France, Mediterranean): a case study of marine plurispecific introductions. Phycologia 44: 477-496.
Wang, H.W., S. Kawaguchi, T. Horiguchi & M. Masuda. 2000. Reinstatement of Grateloupia catenata (Rhodophyta, Halymeniaceae) on the basis of morphology and rbcL sequences. Phycologia 39: 228-237.
Wilkes, R.J., L.M. McIvor & M.D. Guiry. 2005. Using rbcL sequence data to reassess the taxonomic position of some Grateloupia and Dermocorynus species (Halymeniaceae, Rhodophyta) from the north-eastern Atlantic. European Journal of Phycology 40: 53-60.
Womersley, H.B.S. & J.A. Lewis. 1994. Family Halymeniaceae Bory 1828: 158. In: H.B.S. Womersley. Ed. The marine benthic flora of southern Australia. Part IIIA. Bangiophyceae and Florideophyceae (Acrochaetiales, Nemaliales, Gelidiales, Hildenbrandiales and Gigartinales sensu lato). Australian Biological Resources Study, Canberra, pp. 167-218.
Wynne, M.J. 1993. Prionitis pterocladina sp. nov. (Halymeniaceae, Rhodophyta), a newly recognized alga in the western Gulf of Mexico. Botanica Marina 36: 535-543.
Wynne, M.J. 2017. A checklist of benthic marine algae of the tropical and subtropical western Atlantic: fourth revision. Nova Hedwigia Beiheft 145: 1-202.
Yang, M.M. & M.S. Kim. 2014. Cryptonemia asiatica sp. nov. (Halymeniaceae, Rhodophyta), a new marine macroalgal species from Korea and Japan. Journal of Ecology and Environment 37: 387-393.
Zablackis, E. & J. Perez. 1990. A Partially Pyruvated Carrageenan from Hawaiian Grateloupia filicina (Cryptonemiales, Rhodophyta). Botanica Marina 33: 273-276.
Zhao, D., H.W. Wang, Y.W. Sheng, J.Z. Lu & R.X. Luan. 2012. Morphological observation and rbcL gene sequences studies of two new species, Grateloupia dalianensis H.W. Wang et D. Zhao, sp. nov. and G. yinggehaiensis H.W. Wang et R.X. Luan, sp. nov. (Halymeniaceae, Rhodophyta) from China. Acta Oceanologica Sinica 31: 109-120.
Zibetti, R.G.M., M.D. Noseda, A.S. Cerezo & M.E.R. Duarte. 2005. The system of galactans from Cryptonemia crenulata (Halymeniaceae, Halymeniales) and the structure of two major fractions. Kinetic studies on the alkaline cyclization of the unusual diad G2S->D(L)6S. Carbohydrate Research 340: 711-722.
Recibido: 15.10.19
Revisado: 13.01.20
Corregido: 6.02.20
Aceptado: 7.02.20
Revisoras: Ileana Ortegón Aznar y Brigitte Gavio