Un listado del fitoplancton y microfitobentos del sureste del Pacífico mexicano
A checklist of phytoplankton and microphytobenthos of the southeastern Mexican Pacific
Alejandra Torres-Ariño1, Yuri B. Okolodkov2*, Nadia Valeria Herrera-Herrera1,3, Blanca Lorena Hernández-Barrera1,3, Laura González-Resendiz4; Hilda León-Tejera4 e Ismael Gárate-Lizárraga5
1Laboratorio de Biotecnología de Microalgas, Instituto de Industrias, Universidad del Mar, campus Puerto Ángel, Cd. Universitaria s/n, Puerto Ángel, Oaxaca, 70902, México. 2 Laboratorio de Botánica Marina y Planctología, Instituto de Ciencias Marinas y Pesquerías, Universidad Veracruzana, Calle Mar Mediterráneo 314, Fracc. Costa Verde, Boca del Río, Veracruz, 94294, México. 3 Programa de Licenciatura en Biología Marina, Universidad del Mar, campus Puerto Ángel, Cd. Universitaria s/n, Puerto Ángel, Oaxaca, 70902, México. 4 Laboratorio de Ficología Marina, Facultad de Ciencias, Universidad Nacional Autónoma de México, Coyoacán, CdMx, 04510, México. 5 Instituto Politécnico Nacional, Centro Interdisciplinario de Ciencias Marinas, Av. IPN s/n, Col. Playa Palo de Santa Rita, La Paz, Baja California Sur, 23096, México.
*e-mail: yuriokolodkov@yahoo.com
Torres-Ariño, A.; Y.B. Okolodkov; N.V. Herrera-Herrera, B.L. Hernández-Barrera; L. González-Resendiz; H. León-Tejera & I. Gárate-Lizárraga. 2019. Un listado del fitoplancton y microfitobentos del sureste del Pacífico mexicano. Cymbella 5 (1): 1-97. http://cymbella.mx
Resumen
Palabras clave: cianobacterias, fitoplancton, listado florístico, microalgas, Pacífico mexicano.Abstract
Based on the published literature from 1942 to 2018, a taxonomic list of 998 species of cyanobacteria and microalgae from the southeastern Mexican Pacific (Guerrero, Oaxaca and Chiapas states), mainly planktonic and some benthic species that belong to 9 divisions (Bacillariophyta, Dinoflagellata, Cyanobacteria, Ochrophyta, Chlorophyta, Charophyta, Euglenozoa, Haptophyta, Cercozoa), 14 classes, 75 orders, 148 families and 273 genera is presented. Some original fieldwork data obtained in the period 2004-2016 are also included. The first revision of the cyanobacterial biodiversity with new records for the three states was carried out. Diatoms and dinoflagellates are the most diverse and dominant phytoplankton groups, followed by Cyanobacteria, Euglenozoa and those extremely small-celled taxonomic groups (picoplankton) that have not been previously observed. The following genera were more rich in species:
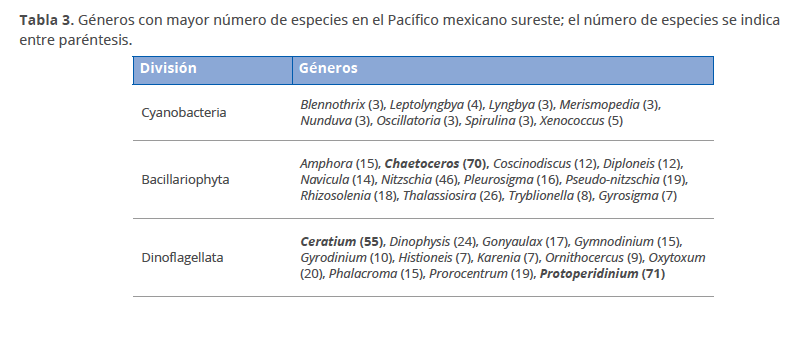
Protoperidinium (71 especies), Chaetoceros (70), Ceratium (55), Nitzschia (46), Thalassiosira (26), Dinophysis (24), Oxytoxum (20), Pseudonitzschia (19), Prorocentrum (19), Rhizosolenia (18), Gonyaulax (17), Pleurosigma (16), Gymnodinium (15), Amphora (15), Phalacroma (15), Navicula (14), Coscinodiscus (12), Diploneis (12), Gyrodinium (10) and Ornithocercus (9). Oaxaca showed 791 species and infraspecific taxa, Guerrero 636 and Chiapas 387. This study contributes with 121 new geographical distribution records of mainly diatoms, cyanobacteria, dinoflagellates and chlorophytes.
Key words: checklist, cyanobacteria, Mexican Pacific, microalgae, phytoplankton.Introducción.
La composición y riqueza de especies de diversos ecosistemas está cambiando como resultado de la destrucción de hábitats, la contaminación, las especies invasoras y el cambio climático (Duffy & Stachowicz 2006). El conocimiento y la preservación de la biodiversidad son actualmente un reto global (Naeem & Li 1997). En los océanos del mundo existe un diverso grupo de microorganismos fotosintéticos que han atraído a investigadores a dirigir su mirada hacia ellos. Dentro de estos microganismos se encuentran las cianobacterias y un diverso grupo de microalgas, algunas de ellas se hallan suspendidas y errantes en la columna de agua y son denominados fitoplancton, mientras que otras se encuentran adheridas a distintos tipos de sustratos orgánicos o inorgánicos y forman parte del microbentos o microfitobentos (principalmente diatomeas, cianobacterias y dinoflagelados).
Estas cianobacterias y microalgas presentan un alto potencial biotecnológico y económico para el desarrollo de procesos sustentables, renovables y amigables con el ambiente debido a que presentan un sistema relativamente simple, puesto que la mayoría son unicelulares; tienen una gran diversidad y capacidad de existir y proliferar en diversos hábitats naturales y condiciones de laboratorio (Satyanarayana et al. 2010). Por su capacidad como fijadoras de nitrógeno atmosférico, se emplean como biofertilizantes y restauradores de suelos agrícolas (Bianchini-Derner et al. 2006). Asimismo, tienen gran relevancia por la versatilidad que ofrecen para producir una gran cantidad de compuestos bioquímicos con la posterior obtención de una amplia variedad de productos de valor agregado para la industria acuícola, alimentaria, cosmética, farmacéutica (altos contenidos de proteínas, lípidos, carbohidratos, pigmentos, antioxidantes, ácidos grasos poliinsaturados, nutracéuticos, ficobiliproteínas, antimicrobianos, proteínas terapéuticas, etc.), los cuales proporcionan la materia prima para conformar productos denominados como “alimentos funcionales”, aunado a las alternativas en la industria energética con los biocombustibles como el bioetanol, biodiesel, biohidrógeno y biopetróleo (Band-Schmidt 1997; Bianchini-Derner et al. 2006; Milledge 2011; Torres-Ariño 2004). Sin embargo, todo programa destinado a la producción industrial y generación económica de microalgas debería realizar una bioprospección permanente, contar con instalaciones para la conservación de cepas y mantenimiento de colecciones (colecciones particulares y/o un Banco Nacional de Algas), con la finalidad de proporcionar un servicio de conservación de la biodiversidad (Torres-Ariño 2008).
La abundancia y composición del fitoplancton y microfitobentos están fuertemente influenciadas por el clima y otras variables ambientales físicoquímicas (Torres-Ariño 2012; Varona-Cordero & Gutiérrez-Mendieta 2003, 2006). Sus especies presentan características fisiológicas, como tasa de crecimiento y reproducción diferentes, y debido a su ciclo de vida corto que les permite tener una rápida respuesta a los factores ambientales tanto naturales como antropogénicos, se les considera como buenos indicadores biológicos de cambios ecológicos y climáticos (Fioroni et al. 2011; Hallegraeff 2010; Poot-Delgado & Okolodkov 2016; Torres 2005).
Algunas especies llegan a formar proliferaciones algales cercanas a sitios de actividad humana (Alves-de-Souza et al. 2008; Reynolds 1997), a veces produciendo impactos drásticos en la calidad del agua, que provocan una condición anóxica hasta causar daños en los mecanismos de respiración en las branquias de peces, producción de toxinas que enferman y envenenan a otras especies, inclusive el hombre, lo que las ha convertido en un asunto prioritario para la salud pública (Reguera 2002), además de afectar los sectores económicos como el pesquero y el turístico (Bravo-Sierra 2004; Sar et al. 2002).
La primera revisión de los estudios del fitoplancton marino de México fue realizada por Hernández-Becerril (1993), quien consideró en su estudio a cianobacterias, diatomeas, dinoflagelados, silicoflagelados, cocolitofóridos, euglénidas, criptofíceas, clorofitas y prasinofíceas. En trabajos posteriores Hernández-Becerril (2003, 2014) incluye a las clases Chrysophyceae, Eustigmatophyceae, Parmophyceae y Raphidophyceae y advierte que el fitoplancton de los estados de Oaxaca y Chiapas es casi desconocido. En las aguas marinas mexicanas un número estimado de especies y taxa infraespecíficos de fitoplancton marino se aproxima a 1,488, perteneciente a 211 géneros, lo que representa entre el 33 y 42 % del total calculado para todos los océanos (Hernández-Becerril 2003). En la actualidad se estima que en el mundo existen unas 5,000 especies de fitoplancton marino distribuidas en aproximadamente 19 clases y siete divisiones (Lee 1996; Tett & Barton 1995).
Los estudios sobre diversidad de fitoplancton del Pacífico mexicano sureste, que incluye a los estados de Guerrero, Oaxaca y Chiapas, datan de inicios de los 1940’s (Osorio-Tafall 1942; en particular, en el Golfo de Tehuantepec y la Bahía de Acapulco), existiendo un vacío en la información hasta los 1980´s, a partir del cual se presentan estudios aislados y revisiones importantes para sitios específicos, pero con falta de periodicidad y amplitud, por lo que la falta de trabajos en la zona es evidente. Respecto a la fracción de fitoplancton de aguas continentales, se conoce que está representado por 15,000 especies en el mundo (Bourrelly 1990), y en México se han registrado 1,526 especies (Eberto Novelo, com. pers., el 9 de octubre de 2019). Novelo & Tavera (2019) han registrado 4,328 nombres de especies y taxa infraespecíficos (sin considerar sinónimos y dos grupos taxonómicos, Charophyta y Bacillariophyta) de algas continentales en México e incluyen especies subaéreas, epipélicas y planctónicas. Respecto a registros de algas continentales por estado, estos autores reportan 424 para Oaxaca, 112 para Chiapas y únicamente dos para Guerrero (Novelo & Tavera 2011).
El objetivo del presente estudio fue la elaboración de un listado de diferentes grupos de microalgas y cianobacterias que forman parte del fitoplancton y del microfitobentos (principalmente de cianobacterias) del Pacífico mexicano sureste.
Material y Métodos.
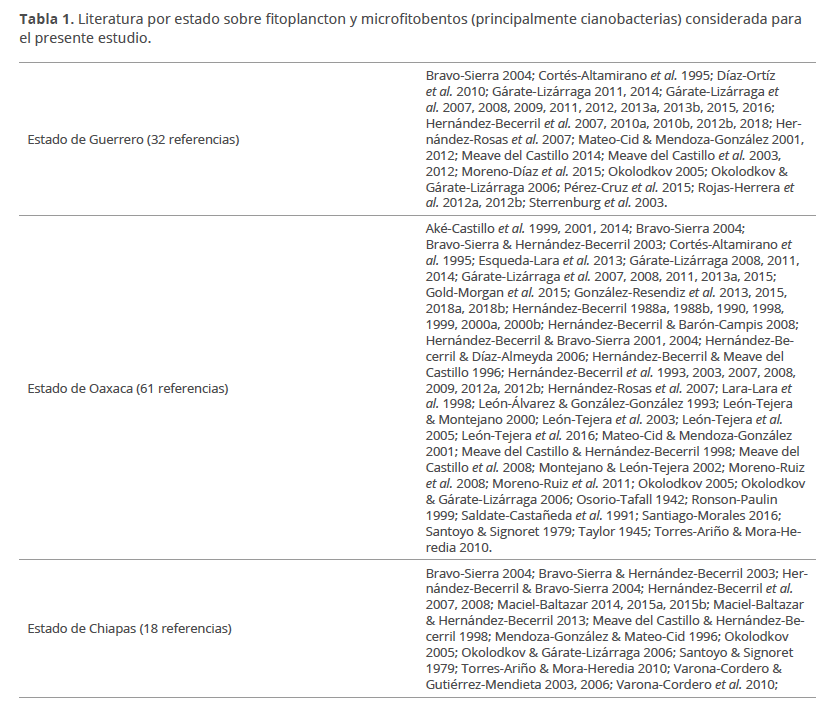
Se recopilaron y analizaron un total de 81 obras publicadas entre 1942 y 2018, en donde algunas de las cuales se comparten entre los estados (Tabla 1). La información recabada de la literatura publicada sobre la riqueza de cianobacterias y microalgas, principalmente planctónicas y en menor medida bentónicas, de los estados que conforman el Pacífico mexicano sureste (Guerrero, Oaxaca y Chiapas), tanto de ambientes marinos, estuarinos o dulceacuícolas que convergen en la zona costera y algunos con influencia de la parte continental, se obtuvo a partir de bases de datos de los autores (artículos indexados y capítulos de libros). Se resalta la información sobre aspectos de sistemática, el número de estudios que depositan muestras en colecciones, así como la importancia ecológica y económica de las cianobacterias y microalgas.
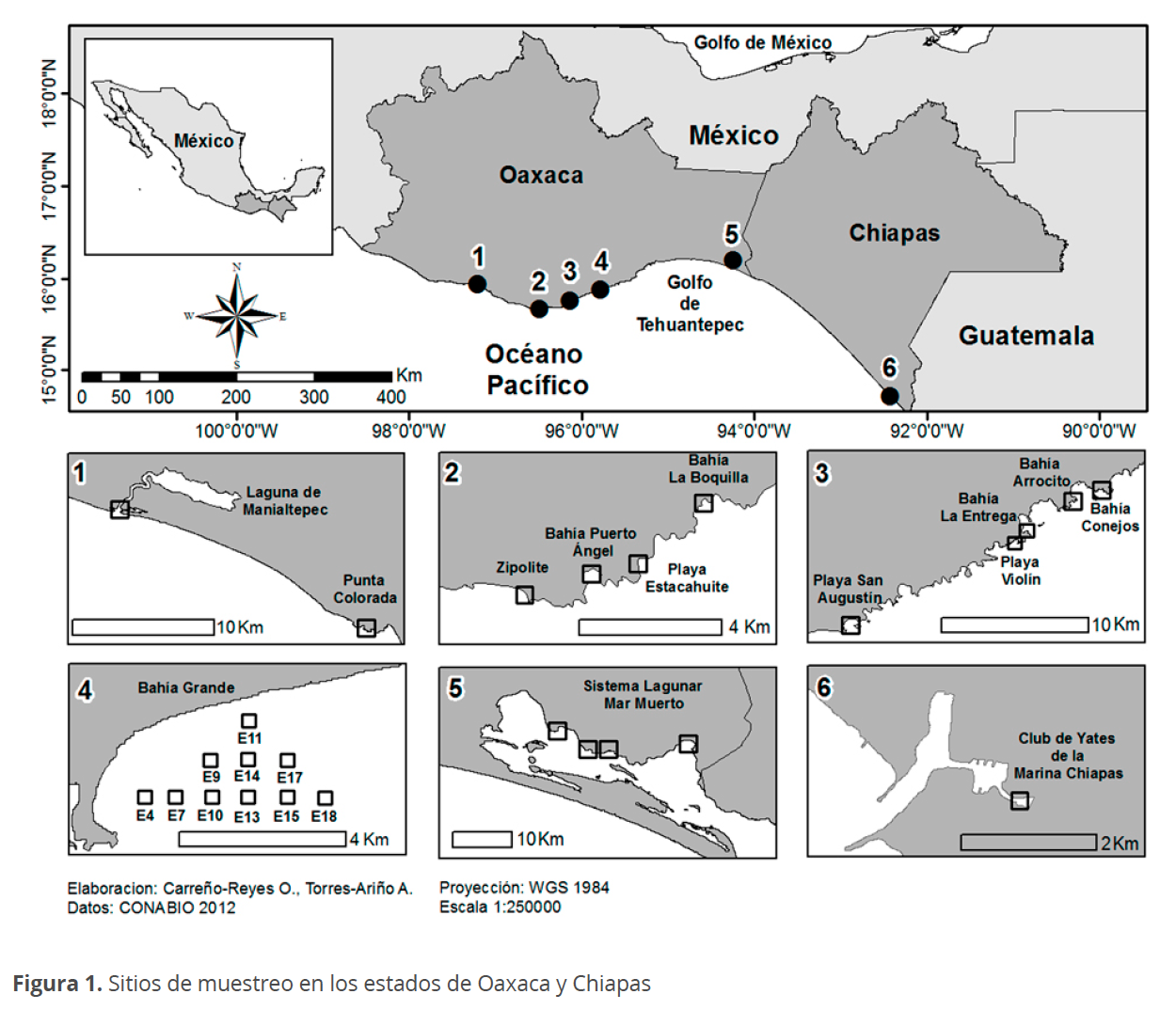
Durante el periodo de 2003 a 2018 se realizaron diversas campañas de recolección de muestras en Oaxaca y Chiapas (Fig. 1) por el Laboratorio de Biotecnología de Microalgas de la Universidad del Mar, campus Puerto Angel (LBM-UMAR) y el Laboratorio de Ficología Marina de la Universidad Nacional Autónoma de México (LF-UNAM), obteniéndose material de la línea de costa (Oaxaca y Chiapas). Las muestras de microfitobentos de la zona litoral rocosa y zona supralitoral (0-7 m sobre el nivel del mar) se obtuvieron mediante raspados manuales con marro y cincel (González-Resendiz et al. 2015; Torres-Ariño 2001).
El fitoplancton (marino y epicontinental) se obtuvo desde pequeñas embarcaciones con motor mediante toma de muestras de agua de la superficie y a diferentes profundidades con una botella Van Dorn (0-20 m), así mismo, se realizaron arrastres verticales hasta 20 m de profundidad y horizontales en la capa superficial de la columna de agua a cinco nudos de velocidad, con redes manuales de plancton de 20 y 65 µm de luz de malla y algunas de ellas por apnea (buceo libre).
Para la fase de identificación de las especies, cada muestra de red o botella de 600 mL fue dividida en submuestras: (1) fijada en formol al 4 % en agua de mar (200 mL) y (2) alícuotas en fresco (200 mL) y su inoculación en medios sólidos ASN III (Rippka et al. 1979, Torres-Ariño 2004) para muestras marinas o BG-11 (Waterbury et al. 1986), para muestras dulceacuícolas de cianobacterias, además de su transferencia a medios líquidos (5 mL/50 mL de medio) ASN III, BG-11, f/2 (Guillard & Ryhter 1962) como en QFF (Torres-Ariño & Mora-Heredia 2010). Para los medios f/2 o QFF empleados para el aislamiento de diatomeas y dinoflagelados se les adicionó silicatos (2mL/L) y óxido de selenio (Rodríguez-Palacio 2006), respectivamente. Simultáneamente, se tomaron datos puntuales de temperatura de agua, salinidad y oxígeno disuelto con una sonda multiparamétrica YSI Model 85 (Yellow Springs, Ohio, EUA).
La identificación de las especies se realizó a partir de las muestras frescas y preservadas con distintos fijadores en campo mediante elaboración de laminillas permanentes de frústulas de diatomeas y su análisis por quintuplicado. Para la limpieza de las frústulas se siguió el método de Simonsen (Hasle & Syversten 1996) y como medio de montaje se utilizó resina sintética SIGMA® diluida con tolueno. Cada muestra fue observada en un microscopio fotónico compuesto Olympus BX51, empleando los objetivos de contraste de fases y microscopía en campo oscuro y las micrografías fueron tomadas con una cámara Nikon D5500 y editadas usando PaintShop Pro X8.
La identificación taxonómica de las especies se realizó mediante el uso de diferentes guías de identificación. Para cianobacterias se consultó a Geitler (1932), Desikachary (1959) y Komárek & Anagnostidis (1986, 1989, 1999, 2005), Komárek & Hauer (2017), para diatomeas a Moreno-Ruiz et al. (1996), Round et al. (1990) y Siqueiros-Beltrones (2002); para los dinoflagelados a Balech (1988), Dodge (1975, 1985, 1989), Licea et al. (1995) y Okolodkov (2005, 2008, 2010, 2014); los silicoflagelados, euglenofitas y crisofitas se identificaron siguiendo a Alonso-Rodríguez et al. (2008), Hallegraeff et al. (2010), Kraberg et al. (2010) y Tomas (1997) y ebriidos con Hargraves (2002).
La información (publicada y de las campañas de muestreo) fue integrada en una base de datos en MS Excel® 2007 (versión 12.0) para conocer el estado del conocimiento a partir del registro de los diferentes taxones de cianobacterias y microalgas de la región. Se han excluido bases de datos no publicadas, informes técnicos, resúmenes de congresos y tesis, y listados que no contaban con una referencia exacta de las especies citadas, así como su ubicación. Para algunos taxones se recopilaron datos de profundidad, coordenadas geográficas de los sitios de muestreo y el ambiente en que se registró. Debido a la discrepancia y variación en el formato de las citas de las autoridades, los nombres de los autores de los taxones (géneros, especies y taxones intraespecíficos) fueron escritos de acuerdo con Brummitt & Powell (1992) para dinoflagelados y diatomeas. Además, para estas últimas se revisó a Spaulding et al. (2010), mientras que para las cianobacterias los nombres de las especies fueron actualizados de acuerdo con Komárek et al. (2014), Komárek & Anagnostidis (1999, 2005) y Hauer & Komárek (2019). De cualquier manera, para éstos y el resto de los grupos la información sobre los autores y el estatus taxonómico de los nombres de los taxones, sinonimia, distribución ecológica y geográfica fue revisada en las bases de datos en línea AlgaeBase (Guiry & Guiry 2019) y WoRMS (Appeltans et al. 2017; WoRMS Editorial Board 2014).
La cianobacteria Dermocarpa acervata se considera nomen ambiguum (el especimen tipo de Dermocarpa P. Crouan & H. Crouan es una mezcla de diferentes especies de distintos géneros); muchas especies descritas dentro del género Dermocarpa han pasado a sinonimia dentro del género Cyanocystis A. Borzi (ver Komárek & Agnostidis, 1986).
En AlgaeBase se encontraron algunas inconsistencias y falta de actualización en los reportes de algunos grupos. Algunos autores (Moreno-Ruiz et al. 2008, 2011, Meave del Castillo et al. 2012) posicionan al género Halamphora (Cleve) Levkov 2009 dentro de la familia Amphipleuraceae (según AlgaeBase), cuando la descripción y segregación de Halamphora incluye la presencia de un engrosamiento en el borde dorsal del rafe y la fascia dorsal está generalmente ausente (Spaulding et al. 2010). Tales características no están descritas en la familia Amphipleuraceae y sí en Catenulaceae, por lo que desde el punto de vista morfológico no existe elemento para incluir Halamphora en Amphipleuraceae (E. Novelo, com. pers.), además de que en la sistemática propuesta por Medlin & Kaczmarska (2004) ambas familias pertenecen a órdenes distintos.
En dinoflagelados los cambios nomenclaturales para las especies marinas del género Ceratium F. Schrank 1793 fueron realizados por Gómez et al. (2010) y Gómez (2013). Sin embargo, ha causado polémica el cambio a Neoceratium F. Gómez, D. Moreira & P. López-Garcia 2010, nom. illeg. (Gómez et al. 2010), y tal cambio fue criticado por Calado & Huisman (2010), y tres años más tarde a Tripos Bory 1823 (Gómez 2013). La práctica del uso de Neoceratium (Gómez et al. 2010) tuvo como consecuencia la publicación de varios trabajos (Ayala et al. 2011, Gárate-Lizárraga 2012; Gárate-Lizárraga et al. 2013b; Meave del Castillo et al. 2012; Rojas-Herrera et al. 2012a, 2012b) con un nombre que actualmente no se considera válido. A pesar de que Gómez (2013) reestablece el género Tripos Bory 1823 para las especies marinas de Ceratium, en AlgaeBase (Guiry & Guiry 2019) incorporan este cambio de 154 especies de Tripos como taxonómicamente aceptadas, nosotros preferimos mantener una actitud crítica, por lo que seguiremos con el uso de Ceratium, continuando la tradición desde 1793 (Schrank 1793).
A partir de estudios morfológicos y moleculares, Moestrup et al. (2014) proponen un nuevo género de dinoflagelados, Levanderina gen. nov. con una sola especie L. fissa (Levander) Ø. Moestrup, Hakanen, G. Hansen, Daugbjerg & Ellegaard 2014 (=Gymnodinium fissum Levander 1894; Gyrodinium instriatum Freudenthal & Lee 1961; Gymnodinium instriatum (Freudenthal & Lee) Coats in Coats & Park 2002). Aunque existe una probable relación con las Gymnodiniaceae con base en su estructura apical compleja, la ultraestructura e información molecular muestran diferencias entre los géneros Gymnodinium F. Stein 1878 y Levanderina e indican una posible relación filogenética entre Levanderina, Akashiwo G. Hansen & Moestrup 2000 y Margalefidinium polykrikoides (Margalef) F. Gómez, Richlen & D.M. Anderson 2017. Aunque la verdadera posición filogenética de Levanderina sigue siendo ambigua, Moestrup et al. (2014) proponen que debe existir una nueva familia y sustentan este hecho debido a la ruta inusual del flagelo longitudinal en un tubo. En el presente estudio se considera que pertenece al orden Gymnodiniales y debiera ser “incertae sedis”.
De igual manera, los autores concordamos con Dodge & Saunders (1985) y Okolodkov (2011), quienes consideran Corythodinium Loeblich Jr. & Loeblich III como sinónimo de Oxytoxum F. Stein. La fórmula tecal de Oxytoxum es Po, 3’, 2a, 3”, 4-5c, 4s, 5”’, 1”” (Okolodkov, 2011), de acuerdo con la interpretación de Dodge & Saunders (1985): Po, 5’, 6”, 5c, 4s, 5”’, 1””. Dodge & Saunders (1985: 100) después de analizar con técnicas de microscopía electrónica de barrido la tabulación de 19 especies con amplia variación morfológica, justifican su ubicación en el género Oxytoxum, debido a que presentan un patrón de tabulación consistente a pesar de la variación en la ornamentación y forma de las placas. Con base en lo anterior, las seis especies de Corythodinium del estudio de Meave del Castillo et al. (2012) se consideran como representantes de Oxytoxum. Asimismo, y de acuerdo con Fensome et al. (1993), Oxytoxum pertenece a la familia Oxytoxaceae Lindemann 1928 dentro de Peridiniphycidae incertae sedis (lo mismo ver en Okolodkov 2011: 13).
Durante la revisión se encontró la controversia sobre la autoría de una nueva especie del género Fryxelliella para el Golfo de Tehuantepec, Oaxaca, la cual fue descrita independientemente como F. pacifica (Hernández-Becerril & Barón-Campis 2008) y F. sepulvedana (Meave del Castillo et al. 2008). Debido a que sólo un nombre puede ser asignado a un taxón, Aké-Castillo et al. (2014) presentan las razones para demostrar que F. sepulvedana es el nombre válido. No obstante, debido al tiempo efectivo de publicación, la prioridad nomenclatural la obtuvo F. pacifica (Hernández-Becerril & Barón-Campis 2014), y F. sepulvedana queda como sinónimo.
Para el área de estudio, el primer trabajo publicado data de 1942 (Osorio-Tafall 1942), por lo que existió un vacío en la información hasta la década de los 1980’s, a partir de la cual se presentan estudios aislados y revisiones importantes para sitios específicos, pero con falta de periodicidad y amplitud, lo que hace evidente la falta de estudios dirigidos en la zona.
Resultados.
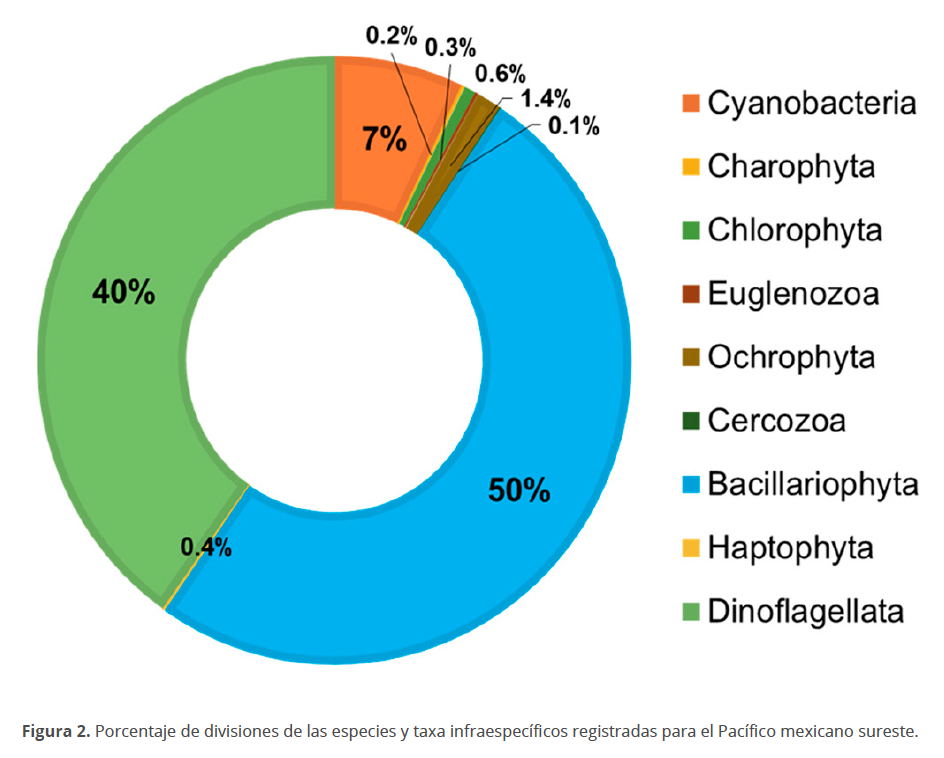
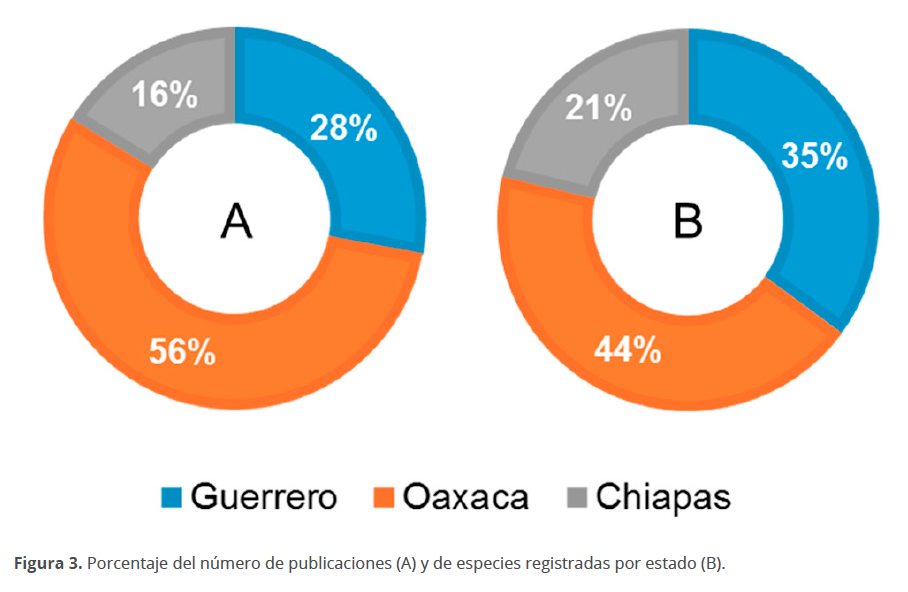
Se registraron un total de 998 especies (Tabla 2, Fig. 2) pertenecientes a 9 divisiones (Cyanobacteria, Charophyta, Chlorophyta, Euglenozoa, Ochrophyta, Cercozoa, Bacillariophyta, Haptophyta, Dinoflagellata). Las especies registradas están comprendidas dentro de 14 clases, 75 órdenes, 148 familias y 273 géneros, con las diatomeas (132 géneros y 498 especies), los dinoflagelados (76 géneros y 401 especies) y las cianobacterias (43 géneros y 71 especies) como los grupos que en orden descendente presentaron mayor riqueza de especies en los ambientes estudiados, como en general se ha encontrado en otras regiones marinas nacionales y del mundo (Hallegraeff et al. 2010; Hernández-Becerril 2014; Kraberg et al. 2010; Torres-Ariño 2012). La mayor parte de publicaciones corresponden al estado de Oaxaca (56 %), seguido de Guerrero (28 %) y Chiapas (16 %) (Fig. 3A). El porcentaje de especies encontradas o registradas por estado es mayor para Oaxaca (44 %), seguida de Guerrero (35 %) y Chiapas (21 %) (Fig. 3B).
Se observó la presencia de otros grupos, cuyo estudio va en aumento, como es el caso de las divisiones Chlorophyta (6 géneros, 7 especies), Haptophyta (2 géneros, 2 especies), Euglenozoa (3 géneros, 3 especies), Charophyta (2 géneros, 2 especies), y dentro de las Ochrophytas, las clases Dictyochophyceae (2 géneros, 6 especies), Xanthophyceae (1 especie), Raphidophyceae (2 géneros, 2 especies), Bolidophyceae (2 géneros, 2 especies) y Cercozoa (1 especie).
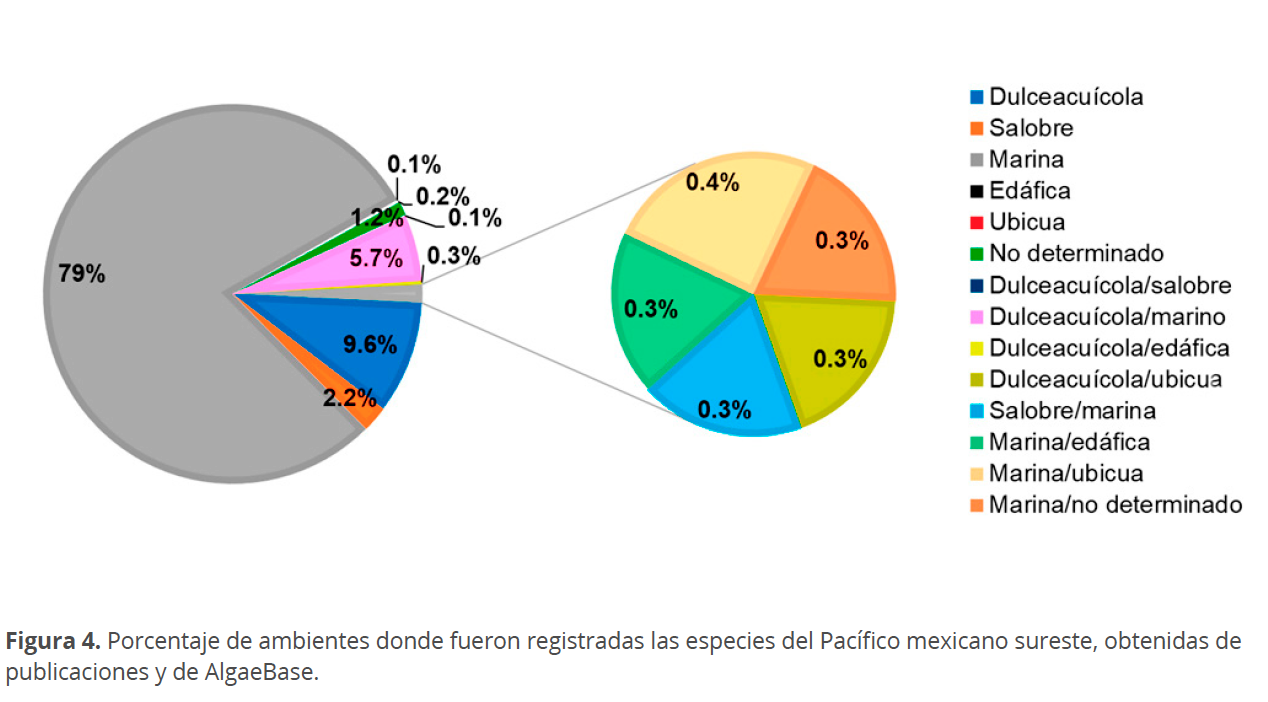
En general, respecto al fitoplancton, se ha observado, que las diatomeas son más abundantes y diversas en la zona costera y los dinoflagelados en la zona oceánica. No obstante, el total de especies registradas hace referencia a la riqueza encontrada para ambientes del Pacífico mexicano sureste, en donde se han estudiado diversos sitios con influencia de la parte continental, costera y oceánica. De estas, el 79 % fueron las especies marinas, 9.6 % dulceacuícolas, 2.2 % salobres, una especie edáfica (sobre tierra en ambientes húmedos o secos), 4 ubicuas, 13 sin determinar su hábitat y 78 especies que se presentaron en más de un ambiente (Tabla 2, Fig. 4).
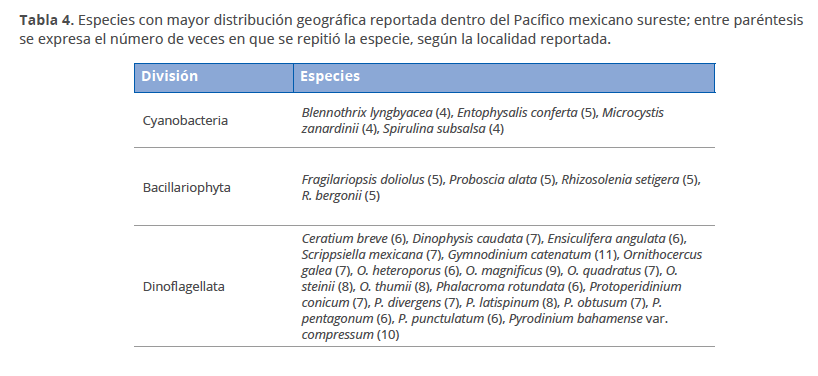
Al comparar la riqueza de especies, el estado de Oaxaca presentó el mayor número de especies (790), centrándose la mayoría de los estudios en el Golfo de Tehuantepec y sistemas lagunares costeros, mientras que Guerrero presentó 636 especies, encontradas en su mayoría en la Bahía de Acapulco y áreas aledañas, y Chiapas presentó 387 especies en el área costera (Paredón) y los sistemas lagunares Chantuto-Panzacola y Carretas-Pereyra. Los géneros con mayor número de especies fueron Protoperidinium (71), Chaetoceros (70) y Ceratium (55)(Tabla 3). Las especies con una distribución más amplia dentro del Pacífico mexicano sureste se presentan en la Tabla 4, dentro de las cuales, Gymnodinium catenatum y Pyrodinium bahamense var. compressum presentaron la mayor distribución geográfica, siendo especies potencialmente tóxicas y unos de los objetos principales en los estudios de florecimientos algales nocivos en México (Gárate-Lizárraga et al. 2015).
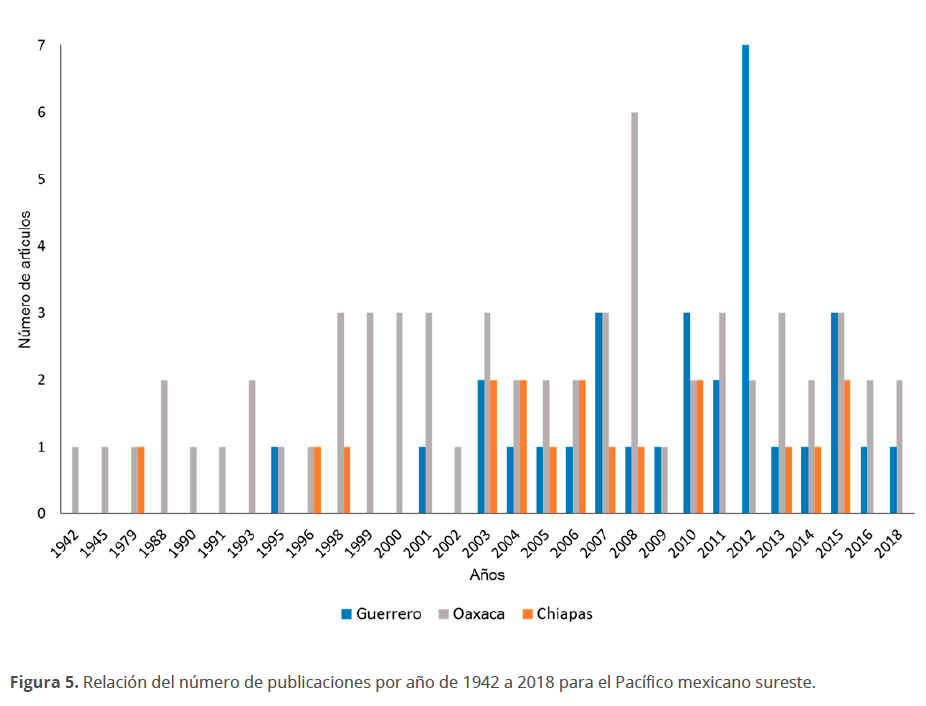
En la figura 5 se presenta el número de artículos publicados para fitoplancton y microfitobentos empleados en este estudio, el cual abarcó de 1942 a 2018 y en ella se observa que hasta 2003 el estado de Oaxaca es en el que se ha realizado mayor esfuerzo de muestreo y sólo unos pocos para Chiapas y Guerrero. A partir de 2004 se observa un mayor aumento en el interés para Oaxaca que para Chiapas y Guerrero. El año con más publicaciones para Oaxaca fue el 2008, mientras que para Guerrero el 2012 y ninguna publicación en 2017.
En la Tabla 2 se hace referencia a las especies de las diversas divisiones en las que este estudio contribuye al conocimiento de la riqueza de especies, integración y ampliación de la distribución geográfica de las mismas, se incluyen un total de 276 especies, de las cuales 121 son nuevos registros para la región (22 cianobacterias, 76 diatomeas, 6 dinoflagelados y 1 clorofita). Se menciona toda la riqueza de especies que interactúa con la zona costera, por lo que se incluyen especies típicas estuarinas o lagunares, así como marinas.
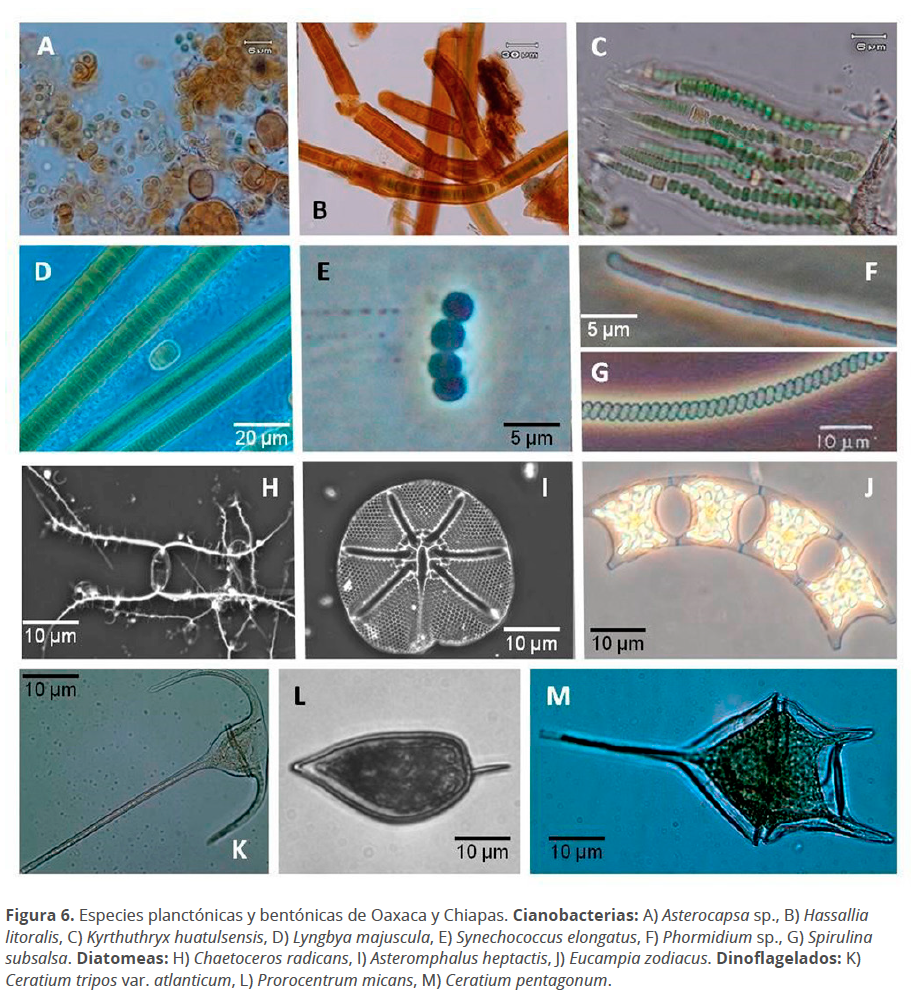
En las figuras 6 y 7 se presentan algunas de las microfotografías tomadas en microscopio fotónico a partir de muestras en fresco para cianobacterias, diatomeas y dinoflagelados, así como de laminillas permanentes para diatomeas. Los géneros de las cianobacterias Asterocapsa y Phormidium se registran por primera vez para el estado de Oaxaca. En total, este estudio contribuyó con 121 registros nuevos, principalmente para Oaxaca y Chiapas, y corroboró 237 especies (Tabla 2, marcadas con asterisco) que fueron encontradas en las muestras, pero que ya habían sido registradas por otros autores.
En aguas mexicanas se han reconocido algunas especies planctónicas del género Synechoccoccus (Hernández-Becerril 2014), lográndose el aislamiento y el cultivo en condiciones controladas de laboratorio de la especie eurihalina S. elongatus (Fig. 6E). De igual manera, se cuentan con cultivos de las especies filamentosas marinas Limnothrix amphigranulata y Lyngbya majuscula (Fig. 6D), las cuales forman parte de la colección de cianobacterias y microalgas del Laboratorio de Biotecnología de Miroalgas de la UMAR (Fig. 8) en donde se mantienen las especies en medio sólido y líquido a 23 ± 1 °C.
Discusión.
La revisión bibliográfica realizada sobre los registros de cianobacterias planctónicas y bentónicas marinas de aguas costeras de Oaxaca, Guerrero y Chiapas constituye la primera recopilación de información sobre el grupo para el Pacífico tropical mexicano (PTM). Sólo 13 publicaciones hacen referencia a este grupo en México (González-Resendiz et al. 2013, 2018a, 2018b; León-Álvarez & González-González 1993; León-Tejera & Montejano 2000; León-Tejera et al. 2003, 2005, 2016; Mateo-Cid & Mendoza-González 2001; Mendoza-González & Mateo-Cid 1996; Montejano & León-Tejera 2002; Taylor 1945; Torres-Ariño & Mora-Heredia 2010) y constituyen en su mayoría estudios realizados en las aguas costeras de Oaxaca, sin existir inventarios previos específicos para este grupo en el PTM. La clasificación utilizada para este grupo ha sido reestructurada a partir de análisis filogenéticos basados en secuencias moleculares (Komárek 2011; Komárek et al. 2014). Para el Pacífico mexicano sureste, pocos estudios (González-Resendiz et al. 2013; León-Álvarez & González-González 1993; León-Tejera & Montejano 2000; León-Tejera et al. 2003; Montejano & León-Tejera 2002) están basados en una colección de referencia con registro internacional (tres instituciones: IPN, UAM, UNAM) y una en proceso de registro (UMAR). El conocimiento de la diversidad de cianobacterias bentónicas marinas en el PTM es todavía deficiente, sin embargo, va en incremento. Considerando que estos organismos desempeñan un papel ecológico preponderante en las comunidades microbianas litorales (González-Resendiz et al. 2013, 2015) y que incluso pueden cubrir áreas considerables del sustrato rocoso o coralino, es necesario fomentar la realización de estudios tanto inventariales como de caracterización taxonómica de ellos en los distintos biotopos de la región.
A escala nacional, Mateo-Cid & Mendoza-González (2001) y Mendoza-González & Mateo-Cid (1996) almacenan sus muestras fijadas en formol al 4 % dentro de la colección del Herbario de la Escuela Nacional de Ciencias Biológicas (ENCB-IPN). Meave del Castillo et al. (2003, 2012) registran muestras de fitoplancton fijadas en formol al 4 % y Lugol ácido que están depositadas en la Colección de Fitoplancton Marino (FpM) de la Universidad Autónoma Metropolitana - Unidad Iztapalapa. Torres-Ariño & Mora-Heredia (2010) mantienen las muestras preservadas en formol al 4 % y con Lugol ácido, así como cultivos, principalmente de cianobacterias, en la Colección de cianobacterias y microalgas del Laboratorio de Biotecnología de Microalgas de la Universidad del Mar, campus Puerto Ángel. González-Resendiz et al. (2013), Hernández-Becerril & Díaz-Almeyda (2006), León-Álvarez & González-González (1993), León-Tejera & Montejano (2000), León-Tejera et al. (2003, 2016) y Montejano & León-Tejera (2002) han registrado muestras secas y en formol al 4 % en la Sección de Algas del Herbario de la Facultad de Ciencias de la UNAM (FCME). La relevancia de mantener colecciones de referencia radica en el hecho de que las condiciones de hábitat están en continuo cambio y las especies responden a esos cambios en cuanto a su abundancia, composición y riqueza o mediante estrategias fisiológicas, estructurales o simplemente aparecen o desaparecen (Duffy & Stachowicz 2006). Las muestras depositadas en colecciones constituyen un banco de información que sirve de referencia para medir y evaluar las relaciones entre los cambios en el ambiente y en las comunidades.
En el ambiente marino existen grupos taxonómicos que parecen ser no tan abundantes, como las Bolidophyta, Dictyochophyta, Raphidophyta, Chlorophyta y Euglenozoa. En estos grupos, prácticamente desconocidos en México, el esfuerzo de estudio debe ser mayor y utilizarse una aproximación polifásica en la que se incorporen, en la medida de lo posible, además de su caracterización morfológica y ecológica tradicional, protocolos especializados como los moleculares (Hernández-Becerril 2014).
Este trabajo se presenta como un estudio de integración florística de los diversos grupos taxonómicos de fitoplancton, si bien es importante realizar descripciones o mostrar ilustraciones que nos permitan certificar la identificación de un alto porcentaje de especies, no siempre es posible presentar por la extensión y número de especies registradas. Se espera que en un futuro la aplicación e integración de diversas herramientas ecológicas, ecofisiológicas, ultraestructurales, bioquímicas y moleculares y la obtención de aislamientos y cultivos puedan aumentar sustancialmente nuestro conocimiento de la riqueza y diversidad de cianobacterias y microalgas, así como de sus ciclos de vida (las fases asexual y sexual). Además, es inherente y fundamental la formación de expertos y grupos de trabajo con enfoque en la taxonomía y estudios de biodiversidad.
Consideraciones Finales.
En las últimas décadas se ha generado una mayor información de la composición del fitoplancton y las cianobacterias en las aguas costeras del Pacifico mexicano. El sureste no es la excepción, ya que este estudio en el que se han enlistado un total de 998 especies de fitoplancton incluyendo cianobacterias de los tres estados (Guerrero, Oaxaca y Chiapas) que conforman esta región. En la actualidad, los estudios sobre la taxonomía del fitoplancton han tenido mucho auge, debido al uso de herramientas moleculares, que han permitido la integración de varias especies en una sola como es el caso de Levanderina fissa. En cuanto a su riqueza de especies, sobresalen las diatomeas y los dinoflagelados, dado que son grupos más conspicuos y que presentan una mayor atención por parte de los investigadores no solo por su interés taxonómico, sino porque algunas especies son toxigénicas y su proliferación puede presentar riesgos para la salud humana, así como para la fauna y flora marina. Tres especies de dinoflagelados, Gymnodinium catenatum, Pyrodinium bahamense y Margalefidinium polykrikoides, han formado proliferaciones recurrentes en la región. Las cianobacterias es un grupo que poco se ha estudiado, sin embargo, en este trabajo se reportan 67 especies, de las cuales 22 son nuevos registros. Este es el primer estudio florístico sobre fitoplancton y microfitobentos (principalmente de cianobacterias) en el Pacifico mexicano sureste. Esta información proporcionará las bases para estudios ecológicos futuros, así como estudios de biogeografía no solo de las especies en general sino de aquellas especies formadoras de florecimientos algales nocivos.
Agradecimientos.
Se agradecen a todos los autores que proporcionaron su bibliografía, a Stephen S. Bates (Fisheries and Oceans Canada, Gulf Fisheries Centre, Moncton, New Brunswick, Canada), David U. Hernández-Becerril (Instituto de Ciencias del Mar y Limnología, UNAM, México) y Francisco O. López-Fuerte (Universidad Autónoma de Baja California, La Paz, B.C.S., México) por la aclaración de nomenclatura y autoría de varios taxones. A Antonio Pineda-Alcázar (Laboratorio Estatal de Salud Pública, Tuxtla Gutiérrez, Chiapas) por la recolecta de muestras de Chiapas, Ana E. Meléndez-Patiño por su apoyo en el ordenamiento de las bases de datos y técnico, a Ruth I. Ramírez-Villanueva y Alejandra Woolrich-Arrioja por el procesamiento de muestras, a los diversos alumnos que contribuyeron con muestras y datos de campo. A Oscar E. Carreño-Reyes por la preparación del mapa y a todos aquellos que contribuyeron en la identificación del fitoplancton. Los autores agradecen a David A. Siqueiros-Beltrones (CICIMAR-IPN, La Paz, Baja California Sur) y Eberto Novelo (Facultad de Ciencias-UNAM, Cd. México) por su apoyo en la sistemática de algunas diatomeas, así como sus comentarios que guiaron la mejora y calidad del manuscrito. Se agradece el apoyo financiero a los proyectos “Potencial biotecnológico de cianobacterias y microalgas de Oaxaca y Chiapas, México” (UMAR-PROMEP 2004-2008, clave 2110004, responsable: ATA), “Los dinoflagelados marinos del estado de Oaxaca, México: morfología, taxonomía, diversidad, ecología y cultivo” (PROMEP, 2004-2005; clave PTC-UMAR-35, responsable: YBO), “Producción, mantenimiento y aislamiento de microalgas” (UMAR-LBM 2004-2013, clave 2II0001, responsable: ATA), así como a los proyectos KT016 financiado por CONABIO e IN223614 “Evaluación de la diversidad taxonómica de cianoprocariontes bénticos marinos del Pacífico mexicano: caracterización fenológica y molecular” e IN225317 “Diversidad taxonómica de los géneros Calothrix, Rivularia y Kyrtuthrix en las costas del Atlántico y Pacífico de México”, financiados por la DGAPA-UNAM (responsable: HLT). IGL es becario COFAA del IPN. Por último y no menos importante, al Dr. Rolando Bastida Zavala quien nos incentivó a realizar este escrito.
Referencias
Aké-Castillo, J.A., D.U. Hernández-Becerril & M.E. Meave del Castillo. 1999. Species of the genus Thalassiosira (Bacillariophyceae) from the Gulf of Tehuantepec, Mexico. Botanica Marina 42: 487-503.
Aké-Castillo, J.A., D.U. Hernández-Becerril, M.E. Meave del Castillo & E. Bravo-Sierra. 2001. Species of Minidiscus (Bacillariophyceae) in the Mexican Pacific Ocean. Cryptogamie Algologie 22: 101-107.
Aké-Castillo, J.A., M.A. Meave del Castillo & M.E. Zamudio-Reséndiz. 2014. Nomenclatural priority of the diatom name Fryxelliella sepulvedana over Fryxelliella pacifica (Triceratiaceae, Bacillariophyta). Phytotaxa 159: 11-16.
Alonso-Rodríguez, R., D.U. Hernández-Becerril & I. Gárate-Lizárraga. 2008. Catálogo de microalgas de las lagunas costeras de Sinaloa. Instituto de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México, México.
Alves-de-Souza, C., M.T. González & J.L. Iriarte. 2008. Functional groups in marine phytoplankton assemblages dominated by diatoms in fjords of southern Chile. Journal of Plankton Research 30: 1233-1243.
Appeltans, W., P. Bouchet, G.A. Boxshall, C. De Broyer, N.J. de Voogd, D.P. Gordon, B.W. Hoeksema, T. Horton, M. Kennedy, J. Mees, G.C.B. Poore, G. Read, S. Stöhr, T.C. Walter & M.J. Costello. 2017. World Register of Marine Species. http://www.marinespecies.org (consultado el 25 marzo de 2017).
Ayala, C., P.A. Martínez, A. Méndez, L.A. Vidal. 2011. Primer registro del dinoflagelado Neoceratium digitatum (Schütt) Gómez, Moreira y López-García 2009 (Dinophyceae), en aguas del Caribe colombiano. Biota Colombiana 12: 145-148.
Balech, E. 1988. Los dinoflagelados del Atlántico Sudoccidental. Ministerio de Agricultura, Pesca y Alimentación, Instituto Español de Oceanografía, Madrid.
Band-Schmidt, C.J. 1997. Generación biotecnológica para la producción de microalgas. Ciencia y Mar 1: 23-30.
Bianchini-Derner, B.R., S. Ohse, M. Villela, S.M. de Carvalho & R. Fett 2006. Microalgas, produtos e aplicações. Ciência Rural 36: 1959-1967.
Bourrelly, P. 1990. Les algues d’eau douce. Initiation à la systematique. Tome I: Les algues vertes. Societè Nouvelle des Èditions Boubèe, Paris.
Bravo-Sierra, E. 2004. Fitoflagelados potenciales tóxicos y nocivos de costas del Pacífico mexicano. Revista de Biología Tropical 52: 5-16.
Bravo-Sierra, E. & D.U. Hernández-Becerril. 2003. Parmales (Chrysophyceae) from the Gulf of Tehuantepec, Mexico, including the description of a new species, Tetraparma insecta sp. nov., and a proposal to the taxonomy of the group. Journal of Phycology 39: 577-583.
Brummitt, R.K. & C.E. Powell. Eds. 1992. Authors of plant names. A list of authors of scientific names of plants with recommended standard forms of their names, including abbreviations. Royal Botanical Gardens, Kew.
Calado, A. & J. Huisman. 2010. Commentary: Gómez, F., D. Moreira & P. López-García. 2010. Neoceratium gen. nov., a new genus for all marine species currently assigned to Ceratium (Dinophyceae). Protist 161: 35-54.
Cortés-Altamirano, R., D.U. Hernández-Becerri & R. Luna-Soria. 1995. Mareas rojas en México: una revisión. Revista Latinoamericana de Microbiología 37: 343-352.
Desikachary, T.V. 1959. Cyanophyta. Indian Council of Agricultural Research, New Delhi.
Díaz-Ortíz, J.A., B. Pérez-Cruz, R. Valdovinos-Sánchez, M.A. Alarcón-Romero, S. López-Silva, L.A. Chávez-Almazán & L. García-Barbosa. 2010. Registro histórico de marea roja en la Bahía de Acapulco de 1992 a 2010. Red Sanitaria 7: 1-4.
Dodge, J.D. 1975. The prorocentrales (Dinophyceae). II. Revision of the taxonomy within the genus Prorocentrum. Botanical Journal of the Linnean Society 71: 103-125.
Dodge, J.D. 1985. Marine dinoflagellates of the British Isles. HM Stationery Office, London.
Dodge, J.D. 1989. Some revisions of the family Gonyaulacaceae (Dinophyceae) based on a scanning electron microscope study. Botanica Marina 32: 275-298.
Dodge, J.D. & R.D. Saunders. 1985. A partial revision of the genus Oxytoxum (Dinophyceae) with the aid of scanning electron microscopy. Botanica Marina 28: 99-122.
Duffy, J.E. & J.J. Stachowicz. 2006. Why biodiversity is important to oceanography: potential roles of genetic, species, and trophic diversity in pelagic ecosystem processes. Marine Ecology Progress Series 311: 179-189.
Esqueda-Lara, K., D. Parra-Toriz & D.U. Hernández-Becerril. 2013. Morphology and taxonomy of Dinophysis species of the section Hastata (Dinoplagellata), including the description of Dinophysis conjuncta sp. nov., from the Mexican marine waters. Journal of the Marine Biological Association of the United Kingdom 93: 1187-1202.
Fensome, R.A., F.J.R. Taylor, G. Norris, W.A.S. Sarjeant, D.I. Wharton & G.L. Williams. 1993. A classification of living and fossil dinoflagellates. Micropaleontology, Special Publication No. 7, American Museum of Natural History, Sheridan Press, Hannover.
Fioroni, S., J. J. Middelburg & J. P. Gattuso. 2011. Testing the effects of elevated pCO2 on Coccolithophores (Prymnesiophyceae): Comparison between haploid and diploid life stages. Journal of Phycology 47: 1281-1291.
Gárate-Lizárraga, I. 2008. Nuevos registros de dinoflagelados planctónicos para el Golfo de Tehuantepec, México. CICIMAR Oceánides 23: 55-65.
Gárate-Lizárraga, I. 2011. New data on the distribution of Spatulodinium pseudonoctiluca (Noctilucales; Kofoidiniaceae) in the Mexican Pacific. CICIMAR Oceánides 26: 33-41.
Gárate-Lizárraga, I. 2012. Proliferation of Amphidinium carterae (Gymnodiniales: Gymnodiniaceae) in Bahía de La Paz, Gulf of California. CICIMAR Oceánides 27: 37-49.
Gárate-Lizárraga, I. 2014. Distribution of Amylax triacantha and A. triacantha var. buxus nov. comb. (Dinophyceae) along the Pacific Coast of Mexico. CICIMAR Oceánides 29: 23-28.
Gárate-Lizárraga I, C.J. Band-Schmidt, G. Verdugo-Díaz, M.S. Muñetón-Gómez & E.F. Félix-Pico. 2007. Dinoflagelados (Dinophyceae) del Sistema Lagunar Magdalena-Almejas. In: Funes-Rodríguez, R., J. Gómez-Gutiérrez & R. Palomares-García. Eds. Estudios Ecológicos en Bahía Magdalena, Centro Interdisciplinario de Ciencias Marinas-Instituto Politécnico Nacional, La Paz, pp: 145-175.
Gárate-Lizárraga I., J.A. Díaz-Ortiz, B. Pérez-Cruz, M. Alarcón-Tacuba, A. Torres-Jaramillo, M.A. Alarcón-Romero & S. López-Silva. 2009. Cochlodinium polykrikoides and Gymnodinium catenatum in Bahía de Acapulco, Mexico (2005–2008). Harmful Algae News 40: 8-9.
Gárate-Lizárraga, I., J.A. Díaz-Ortiz, B. Pérez-Cruz, M.A. Alarcón-Romero, L.A. Chávez-Almazán, J.L. García-Barbosa & S. López-Silva. 2011. A multi-species dinoflagellate bloom and shellfish toxicity in Costa Grande, Guerrero, Mexico. CICIMAR Oceánides 26: 67-71.
Gárate-Lizárraga, I. Pérez-Cruz, B. Díaz-Ortíz, J. & C. Band-Schmidt. 2008. Microalgas y biotoxinas marinas en las costas mexicanas. Conversus 9: 22-26.
Gárate-Lizárraga, I., B. Pérez-Cruz, J.A. Díaz-Ortiz, M. Alarcón-Tacuba, L. Chávez-Almazán, M.A. Alarcón-Romero, S. López-Silva, J.J. Bustillos-Guzmán & S. Licea-Durán. 2012. Toxicity and paralytic toxin profile in Pyrodinium bahamense var. compressum and violet oyster in Bahía de Acapulco, Guerrero, Mexico. Harmful Algae News 45: 2-3.
Gárate-Lizárraga, I., B. Pérez-Cruz, J.A. Díaz-Ortiz, M.A. Alarcón-Romero, L.A. Chávez-Almazán, J.L. García-Barbosa & E. Diego-Valderrama. 2013a. Blooms of Pyrodinium bahamense var. compressum and toxicity in rock oyster at Costa Chica, Guerrero, Mexico. CICIMAR Oceánides 28: 34-42.
Gárate-Lizárraga, I., B. Pérez-Cruz, J. A. Díaz-Ortiz, S. López-Silva, & R. González-Armas. 2015. Distribución del dinoflagelado Pyrodinium bahamense en la costa pacífica de México. Revista Latinoamericana el Ambiente y las Ciencias 16: 2666-2669.
Gárate-Lizárraga, I., B. Pérez-Cruz, J. A. Díaz-Ortiz, Y.B. Okolodkov & S. López-Silva. 2016. Florecimientos algales nocivos en las aguas costeras del estado de Guerrero, México. In: E. García-Mendoza, S.I. Quijano-Scheggia, A. Olivos-Ortiz & E.J. Núñez-Vázquez. Eds. Florecimientos algales nocivos en México. Ensenada. pp: 228-241.
Gárate-Lizárraga, I., G. Sevilla-Torres, M. Álvarez-Añorve, F. Aguirre-Bahena, J. Violante-González & A. Rojas-Herrera. 2013b. First record of a red tide caused by Gyrodinium instriatum (Dinophyceae: Gymnodiniales) in Bahía de Acapulco, Guerrero. CICIMAR Oceánides 28: 43-47.
Geitler, L. 1932. Cyanophyceae. In: L. Robenhorst. Ed. Kryptogamen-Flora von Deutschland, Österreich und der Schweiz, vol. 14. Akademische Verlagsgesellschaft, Leipzig.
Gold-Morgan, M., L. González-Resendiz, H. León-Tejera & G. Montejano. 2015. Description of coccoid cyanoprokaryote Nisada stipitata morphogen et sp. nov. from the supralittoral zone in the tropical Mexican Pacific. Phytotaxa 220: 268-276.
Gómez, F. 2013. Reinstatement of the dinoflagellate genus Tripos to replace Neoceratium, marine species of Ceratium (Dinophyceae, Alveolata). CICIMAR Oceánides 28: 1-22.
Gómez, F., D. Moreira & P. López-García. 2010. Neoceratium gen. nov., a genus for all marine species currently assigned to Ceratium (Dinophyceae). Protist 161: 35-54.
González-Resendiz, L., J.R. Johansen, L. Alba-Lois, C. Segal-Kischinevzky, V. Escobar-Sánchez, L.F. Jiménez García, T. Hauer & H. León-Tejera. 2018a. Nunduva, a new marine genus of Rivulariaceae (Nostocales, Cyanobacteria) from marine rocky shores. Fottea 18: 86-105.
González-Resendiz, L., J.R. Johansen, V. Escobar-Sánchez, C. Segal-Kischinevzky, L.F. Jiménez-García & H. León-Tejera. 2018b. Two new species of Phyllonema (Rivulariaceae, Cyanobacteria) with an emendation of the genus. Journal of Phycology 54: 638-652.
González-Resendiz, L., H.P. León-Tejera, J. Díaz-Larrea, L. Alba-Lois & C. Segal-Kischinevzky. 2013. Hassallia littoralis sp. nov. (Cyanobacteria, Microchaetaceae) from Mexico´s marine supralittoral based on morphological and molecular evidence. Phytotaxa 137: 35-47.
González-Resendiz, L., H. León-Tejera & M. Gold-Morgan. 2015. Morphological diversity of benthic Nostocales (Cyanoprokaryota/Cyanobacteria) from the tropical rocky shores of Huatulco region, Oaxaca, Mexico. Phytotaxa 219: 221-232.
Guillard, R.R.L. & J.H. Ryther. 1962. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detanula confervacea Cleve. Canadian Journal of Microbiology 8: 229-239.
Guiry, M.D. & G.M. Guiry. 2019. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org (consultado el 16 junio de 2019).
Hallegraeff, G.M. 2010. Ocean climate change, phytoplankton community responses, and harmful algal blooms: a formidable predictive challenge. Journal of Phycology 46: 220-235.
Hallegraeff, G.M., C.J.S. Bolch, D.R.A. Hill, I. Jameson, J.M. LeRoi, A. McMinn, S. Murray, M.F. de Salas & K. Saunders. 2010. Algae of Australia: phytoplankton of temperate coastal waters. Australian Biological Resources Study/CSIRO Publishing, Melbourne.
Hargraves, P.E. 2002. The ebridian flagellates Ebria and Hermesinum. Plankton Biology and Ecology 49: 9-16.
Hasle, G.R. & E.E. Syversten. 1996. Marine diatoms. In: C.R. Tomas. Ed. Identifying marine diatoms and dinoflagellates. Academic Press, Inc., San Diego. pp. 5-385
Hauer, T. & J. Komárek. 2019. CyanoDB.cz 2.0 - On-line database of cyanobacterial genera. World-wide electronic publication. University of South Bohemia and Institute of Botany AS CR. http://www.cyanodb.cz (consultado el 17 de enero de 2019).
Hernández-Becerril, D.U. 1988a. Observaciones de algunos dinoflagelados (Dinophyceae) del Pacífico mexicano con microscopio fotónico y electrónico de barrido. Investigaciones Pesqueras 52: 517-531.
Hernández-Becerril, D.U. 1988b. Especies de fitoplancton tropical del Pacífico mexicano. II. Dinoflagelados y cianobacterias. Revista Latinoamericana de Microbiología 30: 187-196.
Hernández-Becerril, D.U. 1990. Observations on the morphology and distribution of the planktonic diatom Neodelphineis pelagica. British Phycological Journal 25: 315-319.
Hernández-Becerril, D.U. 1993. Fitoplancton marino en México. In: S.I. Salazar-Vallejo & N.E. González. Eds. Biodiversidad marina y costera de México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad y Centro de Investigaciones de Quintana Roo, México, pp: 39-53.
Hernández-Becerril, D.U. 1998. Species of the planktonic diatom genus Pseudo-nitzschia of the Pacific coast of Mexico. Hydrobiologia 379: 77-84.
Hernández-Becerril, D.U. 1999. Chaetoceros sumatranus, a member of Chaetoceros section Coarctacti sect. nov. (Bacillariophyceae). Cryptogamie Algologie 20: 95-104.
Hernández-Becerril, D.U. 2000a. Morphology and taxonomy of three little-known marine planktonic Chaetoceros species (Bacillariophyceae). European Journal of Phycology 35: 183-188.
Hernández-Becerril, D.U. 2000b. Morfología y taxonomía de algunas especies de diatomeas del género Coscinodiscus de las costas del Pacífico mexicano. Revista de Biología Tropical 48: 7-18.
Hernández-Becerril, D.U. 2003. La diversidad del fitoplancton marino de México. Un acercamiento actual. In: M.T. Barreiro-Güemes, M.E. Meave del Castillo, M. Signoret-Poillon & G. Figueroa-Torres. Eds. Planctología mexicana, Sociedad Mexicana de Planctología, A.C., La Paz, pp: 1-17.
Hernández-Becerril, D.U. 2014. Biodiversidad de algas planctónicas marinas (Cyanobacteria, Prasinophyceae, Euglenophyta, Chrysophyceae, Dictyochophyceae, Eustigmatophyceae, Parmophyceae, Raphidophyceae, Bacillariophyta, Cryptophyta, Haptophyta, Dinoflagellata) en México. Revista Mexicana de Biodiversidad 85: S44-S53.
Hernández-Becerril, D.U. R. Alonso-Rodríguez, C. Álvarez-Góngora, S.A. Barón-Campis, G. Ceballos-Corona, J. Herrera-Silveira, M.E. Meave del Castillo, N. Juárez-Ruiz, F. Merino-Virgilio, A. Morales-Blake, J.L. Ochoa, E. Orellana-Cepeda, C. Ramírez-Camarena & R. Rodríguez-Salvador. 2007. Toxic and harmful marine phytoplankton and microalgae (HABs) in Mexican coasts. Journal of Environmental Science and Health Part A 42: 1349-1363.
Hernández-Becerril, D.U. & S.A. Barón-Campis. 2008. New species of the diatom genus Fryxelliella (Bacillariophyta), Fryxelliella pacifica sp. nov., from the tropical Mexican Pacific. Phycological Research 56: 149-155.
Hernández-Becerril, D.U & S.A. Barón-Campis. 2014. Comments on the priority of Fryxelliella pacifica over Fryxelliella sepulvedana (Eupodiscaseae, Bacillariophyta). Phytotaxa 175: 235-236.
Hernández-Becerril, D.U., S.A. Barón-Campis & S. Escobar-Morales. 2012a. A new record of Azadinium espinosum (Dinoflagellata) from the tropical Mexican Pacific. Revista de Biología Marina y Oceanografía 14: 553-557.
Hernández-Becerril, D.U., S.A. Barón-Campis & H. Ortiz-Lara. 2012b. A morphological study of epipsammic diatoms (Bacillariophyta) from the tropical Mexican Pacific, including two species of Aulacodiscus, and a description of the new species Cerataulus simsae Hernández-Becerril et Barón-Campis. Botanica Marina 66: 73-84.
Hernández-Becerril, D.U. & E. Bravo-Sierra. 2001. Planktonic silicoflagellates (Dictyochophyceae) from the Mexican Pacific Ocean. Botanica Marina 44: 417-423.
Hernández-Becerril, D.U. & E. Bravo-Sierra. 2004. New records of planktonic dinoflagellates (Dinophyceae) from the Mexican Pacific Ocean. Botanica Marina 47: 417-423.
Hernández-Becerril, D.U., J.G. Ceballos-Corona, K. Esqueda-Lara, M.A. Tovar-Salazar & D. León-Álvarez. 2008. Marine planktonic dinoflagellates of the order Dinophysiales (Dinophyta) from coasts of the tropical Mexican Pacific, including two new species of the genus Amphisolenia. Journal of the Marine Association of the United Kingdom 88: 1-15.
Hernández-Becerril, D.U. & E. Díaz-Almeyda. 2006. The Nitzschia bicapitata group, new records of the genus Nitzschia, and further studies on species of Pseudo-nitzschia (Bacillariophyta) from Mexican Pacific coasts. Nova Hedwigia 130: 293-306.
Hernández-Becerril, D.U., P. Herrera-Herrera, A. Pérez-Mendoza & J.G.A. Ceballos-Corona. 2010a. Marine planktonic diatoms of the order Rhizosoleniales (Bacillariophyta) from the tropical Mexican Pacific. Vie et Milieu 60: 95-107.
Hernández-Becerril, D.U., W.L.S. Lau, K.S. Hii, C.P. Leaw, F. Varona-Cordero & P.T. Lim. 2018. Abundance and distribution of the potentially toxic thecate dinoflagellate Alexandrium tamiyavanichii (Dinophyceae) in the Central Mexican Pacific, using the quantitative PCR method. Frontiers in Marine Science 5: 366. https://doi.org/10.3389/fmars.2018.00366.
Hernández-Becerril, D.U. & M.E. Meave del Castillo. 1996. The marine planktonic diatom Rhizosolenia robusta (Bacillariophyta): morphological studies support its transfer to a new genus, Calyptrella gen. nov. Phycologia 35: 198-203.
Hernández-Becerril, D.U., M.E. Meave del Castillo & M.A. Lara-Villa. 1993. Observations on Chaetoceros buceros (Bacillariophyceae), a rare tropical planktonic species collected from the Mexican Pacific. Journal of Phycology 29: 811-818.
Hernández-Becerril, D.U., M.E. Meave del Castillo & C. Flores-Granados. 2003. Dinoflagelados del orden Dinophysiales en las costas mexicanas. In: M.T. Barreiro-Güemes, M.E. Meave del Castillo, M. Signoret-Poillon & M.G. Figueroa-Torres. Eds. Planctología mexicana. Sociedad Mexicana de Planctología, La Paz, pp: 19-42.
Hernández-Becerril, D.U., S.T. Moreno-Gutiérrez & S.A. Barón-Campis. 2009. Morphological variability of the planktonic diatom Thalassiosira delicatula Ostenfeld emend. Hasle from the Mexican Pacific, in culture conditions. Acta Botanica Croatica 68: 313-323.
Hernández-Becerril, D.U., M.C. Rodríguez-Palacio & C. Lozano-Ramírez. 2010b. Morphology of two bloom forming or potentially toxic marine dinoflagellates from the Mexican Pacific, Heterocapsa pigmaea and Protoceratium reticulatum (Dinophyceae). Cryptogamie Algologie 31: 245-254.
Hernández-Rosas, A., M.E. Meave del Castillo, M.E. Zamudio-Reséndiz & M. Castillo-Rivera. 2007. Morfometría y distribución de especies del género Ornithocercus (Dinophysiales: Dinophyta) del Pacífico Mexicano. Hidrobiológica 17: 257-272.
Komárek, J. 2011. Introduction to the 18th IAC Symposium in České Budějovice 2010, Czech Republic. Some current problems of modern cyanobacterial taxonomy. Fottea 11: 1–7.
Komárek, J. & K. Anagnostidis 1986. Modern approach to the classification system of cyanophytes 2. Chroococcales. Archiv für Hydrobiology/Algological Studies 43: 157-226.
Komárek, J. & K. Anagnostidis 1989. Modern approach to the classification system of cyanophytes 4. Nostocales. Archiv für Hydrobiology/Algological Studies 56: 247-345.
Komárek, J. & K. Anagnostidis. 1999. Cyanoprokaryota. 1. Chroococcales. In: H. Ettl, G. Gärtner, H. Heying & D. Mollenhauer. Eds. Süßwasserflora von Mitteleuropa, vol. 19. Spektrum, Akad. Verl., Heidelberg – Berlin.
Komárek, J. & K. Anagnostidis. 2005. Cyanoprokaryota. 2. Teil: Oscillatoriales. In: Büdel, B., G. Gärdner, L. Krienitz & M. Schagerl. Eds. Süßwasserflora von Mitteleuropa, vol. 19/2. Elsevier, München.
Komárek, J., J. Kastovsky, J. Mares & J.R. Johansen. 2014. Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. Preslia 86: 295-335.
Kraberg, A., M. Baumann & C.L. Dürselen. 2010. Coastal phytoplankton: photo guide for Northern European seas. Verlag Dr. Friedrich Pfeil, München.
Lara-Lara, J.R., E.G. Robles-Jarero, M. del C. Bazán-Guzmán & E. Millán-Nuñez. 1998. Productividad de fitoplancton. In: M. Tapia-García M. Ed. El Golfo de Tehuantepec: el ecosistema y sus recursos. Universidad Autónoma Metropolitana - Unidad Iztapalapa, México. pp: 51-58.
Lee, J.S. 1996. Bioactive components from red tide plankton Cochlodinium polykrikoides. Journal of Korean Fisheries Society 29: 165-173.
León-Álvarez, D. & J. González-González. 1993. Algas costrosas del Pacífico Tropical. In: S.I. Salazar-Vallejo & N.E. González. Eds. Biodiversidad Marina y Costera de México, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad y Centro de Investigaciones de Quintana Roo, México, pp. 456-474.
León-Tejera, H. & G. Montejano. 2000. Dermocarpella (Cyanoprokaryota / Cyanophyceae / Cyanobacteria) from the Pacific coast of México. Cryptogamie Algologie 21: 259-272.
León-Tejera, H.P., G. Montejano & E. Cantoral-Uriza. 2003. Some little known Hydrococcaceae (Cyanoprokaryota) from central México. Algological Studies/Archiv für Hydrobiology 109: 363-374.
León-Tejera, H., G. Montejano & M. Gold-Morgan. 2005. Description of two interesting Scytonematacean populations from supratidal biotopes of the Mexican Pacific. Archiv für Hydrobiology/Algological Studies 117: 307-313.
León-Tejera, H., L. González-Resendiz, J.R. Johansen, C. Segal-Kischinevzky, V. Escobar & L. Alba-Lois. 2016. Phylogenetic position reevaluation of Kyrtuthrix and description of a new species K. huatulcensis from Mexico ́s Pacific coast. Phytotaxa 278: 1-18.
Licea, S., J.L. Moreno, H. Santoyo & G. Figueroa, 1995. Dinoflageladas del Golfo de California. Universidad Autónoma de Baja California Sur, La Paz.
Maciel-Baltazar, E. & D.U. Hernández-Becerril. 2013. Especies de dinoflagelados atecados (Dinophyta) de la costa de Chiapas, sur del Pacífico mexicano. Revista de Biología Marina y Oceanografía 48: 245-259.
Maciel-Baltazar, E. 2014. Nuevos registros de diatomeas del género Pseudonizschia H. Peragallo (Bacillariophyceae) en la costa de Chiapas, México. Lacandonia 8: 15-20.
Maciel-Baltazar, E. 2015a. Nuevos registros de silicoflagelados plántónicos (Dictyophyceae) para la costa de Chiapas, México. Hidrobiológica 25: 383-390.
Maciel-Baltazar, E. 2015b. Dinoflagelados (Dinoflagellata) tóxicos de la costa de Chiapas, México, Pacífico centro oriental. Cuadernos de Investigación UNED 7: 39-48.
Mateo-Cid, L.E. & A.C. Mendoza-González. 2001. Algas marinas bentónicas de la costa de Oaxaca, México. Anales de la Escuela Nacional de Ciencias Biológicas 47: 11-23.
Mateo-Cid, L.E. & A.C. Mendoza-González. 2012. Algas marinas bentónicas de la costa noroccidental de Guerrero, México. Revista Mexicana de Biodiversidad 83: 905-928.
Meave del Castillo, M.E. 2014. Plancton marino introducido por agua de lastre. In: R. Mendoza & P. Koleff (Eds.). Especies acuáticas invasoras en México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México, pp: 289-308.
Meave del Castillo, M.E. & D.U. Hernández-Becerril 1998. Fitoplancton. In: M. Tapia-García. Ed. El Golfo de Tehuantepec: el ecosistema y sus recursos. Universidad Autónoma Metropolitana–Iztapalapa, México, pp: 59-74.
Meave del Castillo, M.E., M.E. Zamudio-Resendiz, Y.B. Okolodkov & I.H. Salgado-Ugarte. 2003. Ceratium balechii sp. nov. (Dinophyceae: Gonyaulacales) del Pacífico mexicano. Hidrobiológica 13: 75-91.
Meave del Castillo, M.E., M.E. Zamudio-Resendiz & L.F. Fernandes. 2008. Fryxelliella sepulvedana sp. nov. (Triceratiaceae, Bacillariophyta), a rare species from the Mexican Pacific coasts. Iheringia 63: 177-185.
Meave del Castillo, M.E., M.E. Zamudio-Resendiz & M. Castillo-Rivera. 2012. Riqueza fitoplanctónica de la bahía de Acapulco y zona costera aledaña, Guerrero, México. Acta Botanica Mexicana 100: 405-487.
Medlin, L.K. & I. Kaczmarska. 2004. Evolution of the diatoms: V. Morphological and cytological support for the major clades and a taxonomic revision. Phycologia 43: 245-270.
Mendoza-González, C. & L.E. Mateo-Cid, 1996. Contribución al estudio de la ficoflora marina de la costa del estado de Chiapas, México. Polibotánica 2: 61-118.
Milledge, J. 2011. Commercial application of microalgae other than as biofuels: a brief review. Reviews in Environmental Science and Biotechnology 10: 31-41.
Moestrup, O., P. Hakanen, G. Hansen, N. Daugbjerg & M. Ellegaard. 2014. On Levanderina fissa gen. & comb. nov. (Dinophyceae) (syn. Gymnodinium fissum, Gyrodinium instriatum, Gyr. uncatenum), a dinoflagellate with a very unusual sulcus. Phycologia 53: 265-292.
Montejano, G. & H. León-Tejera. 2002. Reproduction and baeocyte formation in two species of Dermocarpella (Cyanophyceae). European Journal of Phycology 37: 323-327.
Moreno-Ruiz, J.L., S. Licea-Durán & H. Santoyo. 1996. Diatomeas del Golfo de California. Universidad Autónoma de Baja California Sur, La Paz.
Moreno-Díaz, G., A.A. Rojas-Herrera, J. González-González, J. Violante-González, J.L. Rosas-Acevedo & S. García-Ibáñez. 2015. Variación temporal de la abundancia y composición de especies de fitoplancton colectado con red, en la Bahía de Acapulco, México. Revista Bio Ciencias 3: 88-102.
Moreno-Ruiz, J.L., M. Tapia-García, M.C. González-Macias & M.G. Figueroa-Torres. 2008. Fitoplancton del río Tehuantepec, Oaxaca, México y algunas relaciones biogeográficas. Revista de Biología Tropical 56: 27-54.
Moreno-Ruiz, J.L., M. Tapia-García, S. Licea, M.G. Figueroa-Torres, A. Esquivel, J.E. Herrera-Galindo, J.M. González-Fernández & M.C. González-Macías. 2011. Ecological composition and distribution of the diatoms from the Laguna Superior, Oaxaca, México. Journal of Environmental Biology 32: 425-442.
Naeem, S. & S. Li. 1997. Biodiversity enhances ecosystem reliability. Nature 390: 507-509.
Novelo, E. & R. Tavera. 2011. Un panorama gráfico de las algas de agua dulce de México. Hidrobiológica 21: 333-341.
Novelo, E. & R. Tavera. 2019. bdLACET algas continentales. Un buscador de algas continentales para los ficólogoa y no tan ficólogos. Laboratorio de Algas Continentales, Ecología y Taxonomía, Universidad Nacional Autónoma de México, México, D.F., México. https://bdlacet.mx (consultado el 9 de octubre de 2019).
Okolodkov, Y.B. 2005. Protoperidinium Bergh (Dinoflagellata) in the southeastern Mexican Pacific Ocean: part 1. Botanica Marina 48: 284-296.
Okolodkov, Y.B. 2008. Protoperidinium Bergh (Dinophyceae) of the National Park Sistema Arrecifal Veracruzano, Gulf of Mexico, with a key for identification. Acta Botanica Mexicana 84: 93-149.
Okolodkov, Y.B. 2010. Ceratium Schrank (Dinophyceae) of the National Park Sistema Arrecifal Veracruzano, Gulf of Mexico, with a key for identification. Acta Botanica Mexicana 93: 41-101.
Okolodkov, Y.B. 2011. Dinoflagellata (Bütschli) Fensome, Taylor, Norris, Sarjeant, Wharton et Williams, 1993. In: S.A. Karpov. Ed. Protista, part 3, guide-book on zoology. KMK Sci. Press Ltd., St. Petersburg, Moscow, pp: 7-119, colour figures 8, 9, 11, 12, 14, 15, 17, 22, 31, 33, 37.
Okolodkov, Y.B. 2014. Dinophysiales (Dinophyceae) of the National Park Sistema Arrecifal Veracruzano, Gulf of Mexico, with a key for identification. Acta Botanica Mexicana 106: 9-71.
Okolodkov, Y.B. & I. Gárate-Lizárraga. 2006. An annotated checklist of dinoflagellates (Dinophyceae) from the Mexican Pacific. Acta Botanica Mexicana 72: 1-154.
Osorio-Tafall, B.F. 1942. Notas sobre algunos dinoflagelados planctónicos marinos de México con descripción de nuevas especies. Anales de la Escuela Nacional de Ciencias Biológicas 2: 435-450.
Pérez-Cruz, B., J.A. Díaz-Ortiz, I. Gárate-Lizárraga, D., Garibo-Ruiz, M.A. Mata-Diaz & E. Godoy-Galeana. 2015. Proliferación de Lingulodinium polyedrum en las costas de Guerrero durante la primavera del 2014. Revista Latinoamericana el Ambiente y las Ciencias 16: 208-211.
Poot-Delgado, C.A. & Y.B. Okolodkov. 2016. Microalgae as water quality indicators: an overview. In: M. Snyder. Ed. Aquatic ecosystems: Influences, interactions and impact on the environment. Environmental health – physical, chemical and biological factors. Nova Science Publishers, Inc., Hauppauge, pp: 41-65.
Reguera, B. 2002. Establecimiento de un programa de seguimiento de microalgas tóxicas. In: E.A. Sar, M. E. Ferrario & B. Reguera. Eds. Floraciones algales nocivas en el cono Sur Americano. Instituto Español de Oceanografía, Vigo, pp: 21-54.
Reynolds, C.S. 1997. Vegetation processes in the pelagic: A model for ecosystem theory: Excellence in ecology. Oldendorf/Luhe, Ecology Inst., Oldendorf.
Rippka, R., B.J. Deruelles, B.J. Waterbury, M. Herdman & R. Stanier. 1979. Generic assignments strain histories and properties of pure cultures of cyanobacteria. Journal of General Microbiology 11: 1-61.
Rodríguez-Palacios, M.C. 2006. Establecimiento de cultivos de dinoflagelados del Pacífico Mexicano. Tesis de Maestría en Biología. Universidad Autónoma Metropolitana, México. 113 pp.
Rojas-Herrera, A.A., J. Violante-González, S. García-Ibáñez, V.M.G. Sevilla-Torres, J.S. Gil-Guerrero & P. Flores-Rodríguez. 2012a. Temporal variation in the phytoplankton community of Acapulco Bay, Mexico. Microbiology Research 3: 13-19.
Rojas-Herrera, A.A., J. Violante-González, V.M.G. Sevilla-Torres, J.S. Gil-Guerrero, P. Flores-Rodríguez & J.A. Rendón-Dircio. 2012b. Species composition and abundance of phytoplankton communities in Acapulco Bay, Mexico. International Research Journal of Microbiology 3: 307-316.
Ronson-Paulin, J.A. 1999. Análisis retrospectivo y posibles causas de las mareas rojas tóxicas en el litoral del sureste mexicano (Guerrero, Oaxaca, Chiapas). Ciencia y Mar 3: 49-55.
Round, F.E., R.M. Crawford & D.G. Mann. 1990. Diatoms: biology and morphology of the genera. Cambridge University Press, Cambridge.
Saldate-Castañeda, O., J.L. Vázquez-Castellanos, J. Galván, M.C. Sánchez-Anguillano & A. Nazar. 1991. Intoxicaciones por toxina paralizante de molusco en Oaxaca. Salud Pública de México 33: 240-247.
Santiago-Morales, I.S. 2016. Florecimientos algales nocivos en la costa de Oaxaca. In: E. García-Mendoza, S.I. Quijano-Scheggia, A. Olivos-Ortiz & E.J. Núñez-Vázquez. Eds. Florecimientos Algales Nocivos en México. Ensenada, México. Centro de Investigación Científica y de Educación Superior de Ensenada, La Paz, pp: 242-255.
Santoyo, R.H. & M. Signoret. 1979. Fitoplancton de la Laguna del Mar Muerto en el sur del Pacífico de México. Anales del Centro de Ciencias del Mar y Limnología Universidad Nacional Autónoma de México 6: 71-80.
Sar, E.A., M.E. Ferrario & B. Reguera. 2002. Floraciones algales nocivas en el Cono Sur Americano. Instituto Español de Oceanografía, Madrid.
Satyanarayana K.G., A.B. Mariano & J.V.C. Vargas. 2010. A review on microalgae, a versatile source for sustainable energy and materials. International Journal of Energy Research 35: 291-311.
Schrank, F. von P. 1793. Mikroskopische Wahrnehmungen. Der Naturforscher (Halle) 27: 26-37.
Siqueiros-Beltrones, D.A. 2002. Diatomeas bentónicas de la península de Baja California; diversidad y potencial ecológico. Instituto Politécnico Nacional – Universidad Autónoma de Baja California Sur, La Paz.
Spaulding, S.A., D.J. Lubinski & M. Potapova. 2010. Diatoms of the United States. http://westerndiatoms.colorado.edu (consultado el 22 de octubre 2014).
Sterrenburg, F.A.S., M.E. Meave del Castillo & M.A. Tiffany. 2003. Studies on the genera Gyrosigma and Pleurosigma (Bacillariophyceae): Pleurosigma species in the plankton from the Pacific coast of Mexico, with the description of P. graciliatis sp. nov. Cryptogamie Algologie 24: 291-306.
Taylor, W.R. 1945. Pacific marine algae of the Allan Hancock Expeditions to the Galapagos Islands. Allan Hancock Pacific Expeditions 12: 1-528.
Tett, P. & E.D. Barton. 1995. Why are there about 5000 species of phytoplankton in the sea? Journal of Plankton Research 17: 1693-1704.
Tomas, C.R. Ed. 1997. Identifying marine phytoplankton. Academic Press, San Diego.
Torres-Ariño, A. 2001. Aislamiento y caracterización de cianobacterias marinas productoras de compuestos de interés biomédico. Tesis de Maestría en Ciencias. Centro de Investigación Científica y de Educación Superior de Ensenada, Baja California, México. 94 pp.
Torres-Ariño, A. 2004. Uso de cianobacterias en la producción de antibióticos. Ciencia y Mar 8: 43-52.
Torres-Ariño, A. 2008. Biotecnología microalgal: Lámpara de la acuicultura. Agroproduce 3: 13-16.
Torres-Ariño, A. 2012. Composición temporal del fitoplancton en ambiente de arrecife costero en el sureste de la Península de Baja California. In: M. Pérez-Ramírez & S.E. Lluch-Cota. Eds. Biodiversidad y vulnerabilidad de ecosistemas costeros en Baja California Sur. Aportaciones de estudiantes de grado, posgrado y posdoctorado 2008-2012. Centro de Investigaciones Biológicas del Noroeste, S.C., La Paz, pp: 122-144.
Torres-Ariño, A. & E. Mora-Heredia. 2010. Isolation and characterization of potentially toxic or harmful cyanobacteria from Oaxaca and Chiapas, Mexico. Journal of Environmental Science and Health, Part A 45: 128-136.
Torres, C.G. 2005. Importancia ecológica del fitoplancton durante El Niño 1991-1993, en el Pacífico Ecuatorial (Ecuador). Acta Oceanográfica del Pacífico 13: 1-15.
Varona-Cordero, F. & F.J. Gutiérrez-Mendieta. 2003. Estudio multivariado de la fluctuación espacio – temporal de la comunidad fitoplanctónica en dos lagunas costeras del estado de Chiapas. Hidrobiológica 13: 177-194.
Varona-Cordero, F. & F.J. Gutiérrez-Mendieta. 2006. Composición estacional del fitoplancton de dos lagunas costeras del Pacífico tropical. Hidrobiológica 16: 159-174.
Varona-Cordero, F., F.J. Gutiérrez-Mendieta & M.E. Meave del Castillo. 2010. Phytoplankton assemblages in two compartmentalized coastal tropical lagoons (Carretas-Pereyra and Chantuto-Panzacola, Mexico). Journal of Plankton Research 32: 1283-1299.
Waterbury, J.B., S.W. Watson, F.W. Valois & D.G. Franks. 1986. Biological and ecological characterization of the marine unicellular cyanobacterium Synechococcus. In: T. Platt & W.K.W. Li. Eds. Photosynthetic picoplankton. The Canadian Bulletins of Fisheries and Aquatic Sciences, Department of Fisheries and Oceans, Ottawa, pp: 71-121.
WoRMS Editorial Board. 2014. World Register of Marine Species. http://www.marinespecies.org https://doi.org/10.14284/170 (consultado el 29 abril de 2014).
Revisores: 2 revisores anónimos
Sometido: 21 de enero 2019
Revisado: 17 de mayo de 2019
Corregido 30 de octubre de 2019
Descarga la tabla 02