Viviendo en condominio: las macroalgas y la epibiosis en los ambientes marinos
Nataly Quiroz-González1* y Luis Gabriel Aguilar-Estrada2
1 Laboratorio de Ficología (Biodiversidad Marina), Facultad de Ciencias, UNAM Av. Universidad 3000, Circuito Exterior S/N Delegación Coyoacán, C.P. 04510 Ciudad Universitaria, D.F., México.
2Investigador Posdoctoral CONAHCyT Centro de Investigaciones Biológicas del Noroeste, S. C. (CIBNOR), Programa de Ecología Pesquera, La Paz, México.
Email: natalyquiroz@ciencias.unam.mx
Quiroz-González, N. & L.G. Aguilar-Estrada. 2024. Viviendo en condominio: las macroalgas y la epibiosis en los ambientes marinos. Cymbella 10 (1-3): 19-27.
DOI: https://doi.org/10.22201/fc.24488100e.2024.10.1-3.2
Resumen
La epibiosis es una interacción ecológica importante en los ambientes marinos, se presenta entre distintos grupos de organismos donde destacan las macroalgas, las cuales se han encontrado siendo sustratos, o colonizando a otros seres vivos ya sea heterótrofos o autótrofos. En el presente trabajo se abordan las características principales de la epibiosis, así como sus beneficios y perjuicios, todo esto desde el enfoque de los ambientes marinos y de las macroalgas, además se presentan ejemplos de estos organismos como epífitos, epizoicos y basibiontes. Finalmente, se enfatiza el valor de las comunidades macroalgales epibiontes para el conocimiento de la biodiversidad, el incremento de inventarios florísticos, así como la propuesta de nuevas especies particularmente en México.
Palabras clave: Biodiversidad marina, epífita, epizoica, interacción ecológica, sustratoAbstract
Epibiosis is an important ecological interaction in marine environments. It occurs between different groups of organisms, among which macroalgae stand out. They have been found as substrates or colonizers of other living beings, whether heterotrophic or autotrophic. This article discusses the main characteristics of epibiosis, as well as its advantages and disadvantages, from the perspective of marine environments and macroalgae. Examples of these organisms such as epiphytes, epizootics and basibions are also presented. Finally, the value of epibionts macroalgal communities for biodiversity knowledge, increased floristic inventories and proposed new species, particularly in Mexico, is emphasized.
Key words: Marine biodiversity, epiphyte, epizoic, ecological interaction, substrateLa epibiosis es una de las relaciones ecológicas más recurrentes entre los organismos marinos, donde existe una asociación entre dos seres vivos, uno que participa como sustrato y otro que vive encima de este sin obtener nutrientes de él, es decir sin presentar una relación trófica (Wahl 2009). Es una interacción que en muchas ocasiones lleva al límite a sus participantes con increíbles ventajas y dramáticas consecuencias. Así en el mar encontramos organismos que viven en una clase de condominio o unidad habitacional si los comparamos con nuestras propias vidas y donde las rentas pueden tener un alto o bajo costo.
A los que viven encima de otros seres vivos se les denomina epibiontes, si habitan sobre un organismo autótrofo como algas, pastos marinos o mangles, se les denomina epífitos, si, por el contrario, habitan sobre un animal, se les denomina epizoicos (Wahl 1989). Los hospederos reciben el nombre de basibiontes o forofitos y son capaces de albergar en muchas ocasiones a gran número de epibiontes de distintos grupos taxonómicos (Connelly & Turner 2009, Wahl 2010).
Este tipo de interacción ecológica se ha encontrado principalmente en zonas tropicales y templadas y con menos ejemplos en zonas polares, en distintos ambientes marinos costeros como los arrecifes de coral, las lagunas, los estuarios, los bosques de macroalgas, las zonas rocosas, arenosas, así como en medio del océano. La epibiosis se puede desarrollar en cualquier momento y lugar, de forma leve, moderada o muy intensa y los inquilinos pueden ocupar de manera total o parcial a su hospedero ocasionado importantes consecuencias. Es un fenómeno que puede ser favorable, neutro o perjudicial para el epibionte y/o el basibionte (Arias et al. 2006).
Los basibiontes juegan el rol de hábitats biogénicos, pueden ser muy diversos, se incluyen miembros de distintos grupos dentro de esta categoría, algunos de ellos son: ballenas, tortugas marinas, peces, corales, ascidias, esponjas, briozoos, moluscos, camas de pastos marinos y macroalgas (Madkour et al. 2012). Así mismo, los epibiontes pueden contemplar desde bacterias, protistas, macroalgas y animales, en general, invertebrados como percebes, briozoos, hidroides, poliquetos, esponjas y moluscos (Connelly & Turner 2009, Wahl 2009).
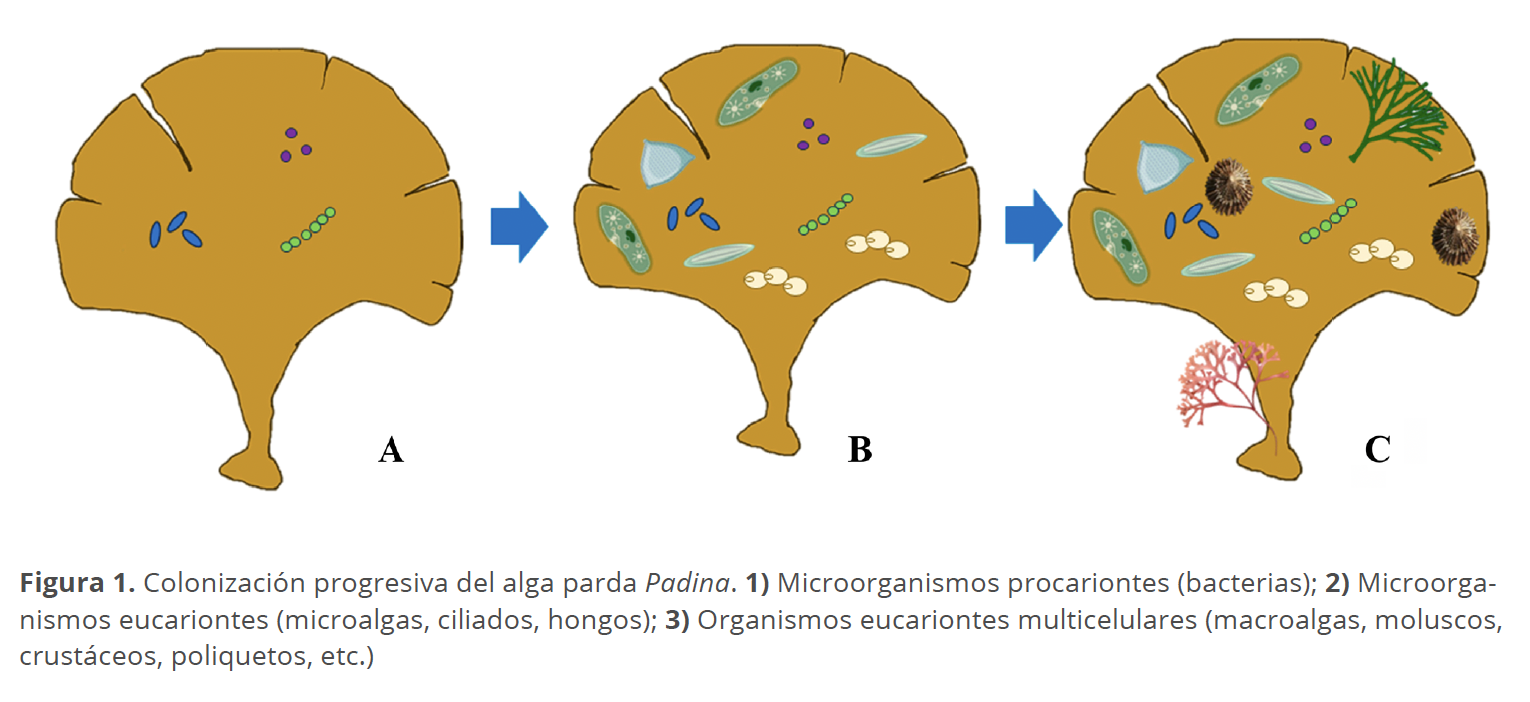
Los primeros organismos en colonizar al basibionte siempre serán bacterias, posteriormente, aparecerán los eucariontes microscópicos como las microalgas, ciliados y levaduras, para dar paso, finalmente, a los organismos multicelulares como las macroalgas o multitud de animales como los balanos o los moluscos, los cuales cuentan con estructuras especializadas o sustancias cementantes que les permiten adherirse a su basibionte (Fig. 1).
La variabilidad, cantidad y calidad de la epibiosis sobre un basibionte específico están determinadas por su disponibilidad estacional, su ubicación diferencial en el cuerpo del organismo sustrato, así como la calidad del basibionte en cuanto a textura, consistencia, forma, inclinación, excreción de sustancias, entre otros. Así los epibiontes, tienen características morfológicas que promueven la colonización no pueden ser más grandes que sus hospederos, deben crecer y reproducirse antes de que su sustrato muera o mude según sea el caso, con esto hacen frente al estilo de vida de su basibionte y resistir los ambientes en los que realice sus actividades (Wahl 1989, 2008).
La conjunción tan estrecha entre el basibionte y sus epibiontes es susceptible de generar una serie de beneficios y perjuicios a ambos organismos que dependen de las características microambientales del basibionte y la densidad de los epibiontes (Aguilar-Estrada et al. 2022).
Beneficios de la epibiosis
Algunos de los beneficios que se han registrado son el decremento de la desecación de los organismos basibiontes a pesar de estar sometidos a los cambios drásticos que se presentan en el litoral (Penhale & Smith 1977), otro es la disminución de la depredación y, por ende, de la mortalidad del basibionte por efecto del camuflaje (Harder 2009). También se ha observado que los basibiontes generan nutrientes que en ocasiones pueden ser aprovechados por los epibiontes. El aumento en el peso de estos últimos debido a los organismos que los colonizan disminuye la posibilidad de ser arrastrados por el oleaje (Wahl 2009).
Para los epibiontes la colonización de un sustrato vivo ofrece un gran número de ventajas, principalmente, el aumento en el número de sustratos colonizables, lo que puede producir el aumento de la superficie ocupada por la especie. El aprovechamiento de los nutrientes generados por el basibionte puede hacer posible el incremento de la tasa de crecimiento del epibionte al tener una mayor cantidad de sustancias inorgánicas aprovechables. Otro aspecto importante es que el basibionte puede ofrecer un medio de transporte para los epibiontes que lo colonizan, lo que favorecerá la dispersión de estos a nuevos sitios (Wahl 1989, Quiroz-González et al. 2020).
Perjuicios de la epibiosis
Algunos de los perjuicios que produce la epibiosis sobre los basibiontes incluyen el gasto de energía a través del arrastre de los epibiontes sobre el basibionte (Donovan et al. 2003) y la disminución de la flotabilidad en libre nadadores debido al aumento de peso por la densidad de epibiontes (McAllen & Scott 2000). Estos pueden provocar daño mecánico por el tipo y cantidad de estructuras de soporte sobre la superficie del basibionte, así como daño químico debido a la liberación de sustancias que pudieran ser tóxicas, así como la disminución en la absorción de nutrientes o en el intercambio gaseoso (Harder 2009). Esta relación basibionte-epibionte puede afectar negativamente a los basibiontes a través de una mayor depredación, debido al hecho de vivir juntos por un lapso prolongado que los condiciona y presiona a tener a lo largo del tiempo un destino compartido (Manning & Lindquist 2003).
El movimiento y el modo de vida de muchos basibiontes pueden reducir la cantidad de epibiontes por quedar sujetos a cambios drásticos de condiciones ambientales o efectos de abrasión y desecación (Bell 2005). Sin embargo, el mayor peligro del epibionte es ser víctima de los depredadores del basibionte (Wahl 1989).
Todos estos efectos son costosos y pueden reducir la supervivencia del basibionte y del epibionte, así como poner en detrimento su capacidad de defensa ante depredadores o su posible competencia entre individuos de su propia especie. Para mediar el efecto de la epibiosis que en muchas ocasiones puede comprometer al basibionte, estos han desarrollado una serie de adaptaciones.
Adaptaciones a la epibiosis
Existen tres mecanismos para impedir, disminuir o simplemente tolerar la epibiosis, estos se denominan: evitación, defensa y tolerancia. La tolerancia es ejercida por organismos sedentarios como bivalvos, poliquetos, percebes y tunicados, a los que la colonización casi ilimitada no les afecta. Son indiferentes a los epibiontes siempre y cuando los orificios del cuerpo (bordes de conchas, tubos y sifones) no estén cubiertos. Por otro lado, los basibiontes que evitan la epibiosis recurren a distintas estrategias como tener un crecimiento acelerado, donde la renovación de tejidos supera la tasa de epibiosis, la disminución de sustancias antiincrustantes en las zonas viejas del talo para evitar la epibiosis en los tejidos jóvenes, o la mayor inversión de energía en la reproducción que garantice mayor número de individuos disponibles para ser colonizados. Finalmente, algunos organismos desarrollan mecanismos de defensa físicos y químicos. Respecto a los físicos, el desprendimiento de cutículas y tejidos epidérmicos es un mecanismo común para eliminar organismos epibióticos, o la producción de mucus o limo para evitar el asentamiento de estos, mientras que la defensa química se basa en crear un ambiente desfavorable con valores de pH extremos, o la generación de sustancias antiincrustantes, que limitan el crecimiento en la cercanía o pueden ser limitante en el desarrollo de adultos o de plántulas, lo que se denomina alelopatía (Budzalek et al. 2021, Wahl 1989).
Los estudios de epibiosis marina se han centrado en animales carismáticos como las ballenas o las tortugas marinas que fungen como basibiontes, y, en menor medida, se ha considerado a los invertebrados y a los organismos fotosintéticos como las macroalgas, pastos marinos y mangles. A continuación, se señalan algunos ejemplos del desarrollo de la epibiosis entre macroalgas con otros grupos de seres vivos como vertebrados, invertebrados y organismos fotosintéticos.
Macroalgas y vertebrados
Es común encontrar en las distintas fuentes de información una mayor cantidad de trabajos con vertebrados libre nadadores con epibiontes como ballenas, peces y tortugas marinas.
En las ballenas y delfines son las diatomeas, cianobacterias y algas verdes epizoicos los más comunes, mientras que los grupos de macroalgas no se han registrado de manera frecuente (Birkum & Goldin 1997). En la ballena jorobada se pueden encontrar epibiontes en el borde de las aletas, así como en la cabeza, sobre la piel de este mamífero pueden crecer aglomeraciones de diatomeas que forman manchas de tonos amarillentos, anaranjados y cafés que se observan con tonalidades claras (Haro 2009).
Las tortugas marinas y en particular su caparazón es uno de los sustratos vivos preferidos por diversas comunidades de epibiontes (Pfaller et al. 2008) al ser un sustrato móvil (Fuller et al. 2010). Así, las tortugas son uno de los organismos, en los que más estudios se han llevado a cabo para conocer la composición de especies epibiontes (Domènech, et al. 2015). Los géneros de algas comúnmente encontrados en sus caparazones son: Cladophora Kützing, Polysiphonia Greville y Ulva Linnaeus (Lara-Uc & Mota-Rodríguez 2014). La tortuga caguama (Caretta caretta Linnaeus) es la especie más susceptible a ser colonizada por organismos epibiontes tanto vegetales como animales; la gran mayoría de las macroalgas identificadas en estos reptiles son algas rojas filamentosas pequeñas de amplia distribución geográfica (Báez et al. 2005). Las tortugas carey (Eretmochelys imbricata Linnaeus) han llegado a ser colonizadas hasta por 38 especies de algas distintas, siendo este el mayor registro hasta el momento para dicha tortuga mexicana. Sentíes et al. (1999) reportaron a Chaetomorpha linum (O.F. Müller) Kützing, Sphacelaria tribuloides Meneghini, Centroceras clavulatum (C. Agardh) Montagne, Erythrotrichia carnea (Dillwyn) J. Agardh y Champia parvula (C. Agardh) Harvey sobre tortugas marinas en el Caribe.
En peces, Báez et al. (2003) registraron dos especies de algas (Ectocarpus siliculosus (Dillwyn) Lyngbye y Blidingia marginata (J. Agardh) P.J.L. Dangeard ex Bliding) como epizoicas del pez espada (Xiphias gladius Linnaeus). En los peces escorpión en Puerto Rico, Ballantine et al. (2001) encontró 33 especies de algas epizoicas, principalmente, de algas rojas como Antithamnionella breviramosa (E.Y. Dawson) Wollaston, Asparagopsis taxiformis (Delile) Trevisan, Centroceras clavulatum y varias especies de Ceramium Roth.
Macroalgas e invertebrados
Se han realizado estudios enfocados al conocimiento de las algas epizoicas de las comunidades marinas, sobre todo, en organismos como los crustáceos, esponjas, corales y moluscos. Los crustáceos poco móviles como los cangrejos araña (Schizophrys dahlak Griffin & Tranter) pueden ser colonizados por una gran cantidad de epibiontes; entre ellos se pueden encontrar algas como diatomeas y clorofitas, mismas que le proveen camuflaje, lo que les protege de posibles amenazas de depredadores (Madkour et al. 2012).
En otros crustáceos, como los percebes del género Balanus Costa, existe una relación particular con los géneros de algas verdes Ulva y Enteromorpha Link, ya que estas requieren espacios libres sobre las rocas para poder colonizarlos; sin embargo, en muchas ocasiones estos sitios ya están ocupados por los percebes, lo que propicia que las algas crezcan sobre la superficie de carbonato de calcio que constituye el exoesqueleto de estos crustáceos (Granhag et al. 2004).
Las esponjas ejercen diversos roles ecológicos que son importantes para los organismos que las colonizan. Uno de los principales es la provisión de refugio, ya que en sus periodos de crecimiento y decrecimiento corporal, crean espacios libres para otros organismos competitivamente inferiores, son sitios de refugio para posibles depredadores (Arias et al. 2006, Gastaldi et al. 2015). En la mayoría de las ocasiones la relación entre algas y esponjas no genera daños para esta, sin embargo, también se pueden mencionar algunas asociaciones negativas, como el sombreado que las macroalgas pueden producir sobre el cuerpo de la esponja o la reducción del crecimiento lateral de las esponjas debido al contacto con la macroalga (Gastaldi et al. 2015). En el estudio de Quiroz-González et al. (2020) para el Pacífico tropical mexicano, se registraron 12 especies de algas colonizando a esponjas marinas: Amphiroa misakiensis Yendo, Bryopsis hypnoides J.V. Lamouroux, Caulerpa sertularioides (S.G. Gmelin) M. Howe, Codium setchellii N.L. Gardner, Cladophora microcladioides N.L. Gardner, Ceramium caudatum Setchell & N.L. Gardner, Gayliella dawsonii (A.B. Joly) Barros-Barreto & F.P. Gomes, Derbesia marina (Lyngbye) Solier, Gelidium pusillum (Stackhouse) Le Jolis, Polysiphonia sertularioides (Grateloup) J. Agardh, Hypnea johnstonii Setchell & N.L. Gardner, Gracilaria veleroae E.Y. Dawson.
En cuanto a la relación entre algas epibiontes y corales, esta se ha documentado recurrentemente y se ha determinado que las macroalgas son un componente importante en las comunidades de arrecifes coralinos, ya que intervienen directamente en su estructuración y mantenimiento (McCook 1996, Gómez-Cubillos et al. 2019). En el Pacífico tropical mexicano, Quiroz-González et al. (2020) registraron 23 especies de algas creciendo sobre corales. Si bien es cierto que los corales pueden ser un sustrato adecuado para distintos epibiontes en el caso particular de la relación alga-coral, esta puede derivar en una competencia directa ya sea por espacio, luz o nutrientes (Barrios et al. 2003), y en algunos casos se ha documentado que si el crecimiento de las macroalgas filamentosas que cubren a los corales es desmesurado, se puede generar el desplazamiento del coral e incluso provocar su muerte (Vázquez-Texocotitla 2013, Corado-Nava et al. 2014).
En los moluscos se ha observado que sus conchas pueden ser hábitats importantes de organismos epibiontes en ambientes donde los sustratos rocosos son muy escasos o están densamente colonizados, y donde la competencia por espacio es elevada (Vasconcelos et al. 2007). Se ha observado que las conchas como basibiontes aumentan la abundancia de las especies de epibiontes, ya que estas superficies proveen un mecanismo de colonización alternativo y, por esta razón los epibiontes pueden aumentar su supervivencia (Wahl 1989, Creed 2000). La superficie provista por la concha determinará la tasa de colonización y la cantidad de epibiontes (Vasconcelos et al. 2007, Wernberg et al. 2010). Las conchas pueden ofrecer a los epibiontes protección contra la depredación y la perturbación (Beekey et al. 2004, Passarelli et al. 2014), así como proporcionar una mayor irradiación a organismos fotosintéticos, condiciones nutricionales más favorables y transporte (Wahl 1989).
El establecimiento de epibiontes se ha observado en, caracoles y lapas, bivalvos, poliplacóforos y conchas con cangrejos ermitaños (Creed 2000, Connelly & Turner 2009, Levenets et al. 2010). En el mundo se ha documentado la interacción entre moluscos y algas en Argentina, Chile, Japón y Estados Unidos, donde géneros como Acrochaetium Nägeli, Chaetomorpha Kützing, Cladophora, Derbesia Solier, Gelidium J.V. Lamouroux, Lithothamnion Heydrich y Lithophyllum Philippi fueron frecuentemente registrados como epibiontes de bivalvos, gasterópodos y quitones (Bretos & Chihuailaf 1990, Connelly & Turner 2009, Levenets et al. 2010). En México se están haciendo esfuerzos por conocer a las especies de macroalgas sobre moluscos, como los quitones y gasterópodos, y el efecto de su epibiosis; se han registrado un gran número de especies de algas epizoicas, donde incluso se han señalado nuevos registros para México. Para el Pacífico tropical mexicano se han registrado hasta el momento 124 especies de algas marinas epizoicas en moluscos, esponjas, corales vivos y balanos (Quiroz-González et al. 2020, Aguilar-Estrada et al. 2022) (Fig. 2).
Macroalgas y organismos fotosintéticos (algas, pastos marinos y mangles)
El epífitismo es una forma de vida que consiste en la interacción entre dos o más organismos que se fijan a un sustrato vegetal para vivir; en los ambientes marinos los basibiontes pueden estar representados por macroalgas, pastos marinos o mangles (Borowitzka & Lethbridge 1989, Quiroz-González et al. 2023). El epífitismo es una relación común adoptada con la que se evita la competencia por espacio o por la luz del sol. Esta relación es permanente o puede presentarse sólo por una etapa en el desarrollo del organismo epífito. Las algas epífitas, a pesar de su tamaño reducido, contribuyen a la producción primaria de los ecosistemas marinos, ya que suponen un aumento de biomasa para los organismos herbívoros como los peces, crustáceos, equinodermos y moluscos; además, participan en el flujo de nutrientes, la acumulación de sedimentos y la riqueza de especies de los ecosistemas marinos (Borowitzka et al. 2006). Pueden proporcionar datos a largo plazo sobre la calidad del agua y del medio ambiente, por lo que poseen un potencial importante en el desarrollo de programas de monitoreo (Quiroz-González et al. 2023).
Muchas algas que son epífitas presentan estrategias oportunistas, es decir, ocupan el sustrato en determinadas circunstancias sin estar restringidas a un sólo hospedero. Contrario a esto, existen especies con un alto grado de especificidad entre ambos organismos; por esta razón se les denomina algas epífitas obligadas. Ejemplo de lo anterior son las algas rojas de los géneros Erythrotrichia Areschoug y Sahlingia Kornmann, las cuales pasan toda su vida encima de otra alga o pasto marino (Álvarez-Álvarez et al. 2020).
Con respecto a los individuos que son hospederos o basibiontes, las macroalgas junto con los pastos marinos son sustratos por excelencia, particularmente, aquellas especies que se encuentran de manera permanente, ya que su longevidad le permite al epífito completar su ciclo de vida. Además, les proporcionan el espacio necesario para vivir, así como un refugio contra depredadores, son zonas de alimentación para las especies herbívoras o participan como trampas de sedimentos en ambientes litorales (Quiroz-González et al. 2023). Los pastos marinos del género Thalassia K.D. Koenig han sido los hospederos más estudiados a lo largo de las últimas décadas. Existen registros en la literatura, que permiten conocer el desarrollo de algas en áreas donde el sustrato blando constituye una limitante para su establecimiento. Se han registrado numerosas especies de algas desarrollándose sobre sus frondas, de los cuales destacan algas verdes como Chaetomorpha y Cladophora, así como algas rojas de los géneros Erythrotrichia, Centroceras, Ceramium y Polysiphonia (Saunders et al. 2003, Nava-Olvera et al. 2017).
Las algas pardas representan el sustrato vegetal más común donde se fijan los organismos epífitos, gracias a su talla y amplias frondas particularmente en ambientes templados. Las especies de los géneros Macrocystis C. Agardh y Laminaria J.V. Lamouroux, importantes formadoras de bosques de macroalgas destacan por ser hospederos de distintos grupos de algas, mientras que en las zonas tropicales entre las algas pardas se ha registrado mayor número de epibiontes en las que que pertenecen a los géneros Padina Adanson y Sargassum C. Agardh (Álvarez-Álvarez et al. 2020; Montañés et al. 2003, Ortuño-Aguirre & Riosmena-Rodríguez 2007).
La relación entre el epífito y el basibionte se fundamenta en bases químicas, físicas y ecológicas. De manera general, el organismo epífito requiere un conjunto de condiciones que el basibionte le proporciona para su desarrollo. Esta interacción puede presentar efectos negativos en el basibionte como la reducción en la captación de la energía lumínica para la fotosíntesis u otros que son considerados positivos como la limpieza y protección contra los depredadores del tejido por parte de los epífitos hacia el basibionte. El epífitismo es una de las relaciones ecológicas menos conocida en los ambientes acuáticos. Son aún escasos los estudios donde se llevan a cabo análisis de las adaptaciones, tolerancia climática, tipos y características de los sustratos.
En México se han registrado 615 especies de macroalgas epífitas, que representan el 37% de la riqueza de macroalgas en todo el país (Quiroz-González et al. 2023). Su estudio ha cobrado interés al considerar su valor crucial en los ambientes marinos, su importancia para el conocimiento de nuevos registros incluso nuevas especies.
La epibiosis es una interacción ecológica importante para las macroalgas, ya que les permite colonizar otro tipo de sustratos, sobre todo, en ambientes donde las rocas no son abundantes o existe mucha competencia por el espacio. Su estudio requiere de una mayor profundización a nivel taxonómico y ecológico.
Agradecimientos
A los estudiantes de la asignatura “Interacciones ecológicas de invertebrados y vegetación marina” de la Facultad de Ciencias, UNAM por las fotografías.
REFERENCIAS
Aguilar-Estrada, L.G., N. Quiroz-González, I. Ruiz-Boijseauneau, L. Álvarez-Castillo, & D. Rodríguez. 2022. Algal epibiont species on Chiton articulatus (Mollusca: Polyplacophora) from a rocky intertidal coast from the Mexican Tropical Pacific. Revista Mexicana de Biodiversidad 93: 1-14. https://doi.org/10.22201/ib.20078706e.2022.93.4163.
Álvarez-Álvarez, J.E., N. Quiroz-González, D.L. Rodríguez-Muñoz & L.G. Aguilar-Estrada. 2020. Algas epífitas en Padina durvillei y P. crispata (Dyctiotaceae, Phaeophyceae) en el Pacífico tropical mexicano. Acta Botanica Mexicana 127: e1594. https://doi.org/10.21829/abm127.2020.1594.
Arias, J., S. Zea, F. Newmark & M. Santos-Acevedo. 2006. Determinación de la capacidad antiepibiótica de los extractos orgánicos crudos de las esponjas marinas Cribrochalina infundibulum y Biemna cribaria. Boletín de Investigaciones Marinas y Costeras-INVEMAR 35: 91-101. DOI: 10.25268/bimc.invemar.2006.35.0.218.
Báez, J.C., J.M. De la Serna, D. Macías & A. Flores-Moya. 2003. Notas sobre las macroalgas epizoicas que crecen sobre la espada de pez espada, Xiphias gladius (Linnaeus, 1758) (Teleostei, Xiphidae), capturado en el Mediterráneo occidental. Boletín de la Real Sociedad Española de Historia Natural (Sección Biológicas) 98: 5-7.
Báez, J.C., J.A. Camiñas & A. Flores-Moya. 2005. La tortuga boba: todo un ecosistema marino. Spin Cero 9: 39-41.
Ballantine, D., N. Navarro, & D. Hensley. 2001. Algal colonization of Caribbean scorpion fishes. Bulletin of Marine Science 3: 1089-1094.
Barrios, J., S. Sant, E. Méndez & L. Ruiz. 2003. Macroalgas asociadas a arrecifes coralinos en el Parque Nacional Mochima, Venezuela. Saber 15: 28-32.
Beekey, M.A., D.J. McCabe, & J.E. Marsden. 2004. Zebra mussels affect benthic predator foraging success and habitat choice on soft sediments. Oecologia 141:164-170. https://doi.org/10.1007/s00442-004-1632-1.
Bell, J.J. 2005. Influence of occupant microhabitat on the composition of encrusting communities on gastropod shells. Marine Biology 147: 653-661. https://doi.org/10.1007/s00227-005-1587-8.
Birkun, J.A. & E.B. Goldin. 1997. Microphytic algae in the pathology of the cetaceans. Mikrobiolohicheskiy Zhurnal 59: 96-105.
Borowitzka, M.A. & R.C. Lethbridge. 1989. Seagrass epiphytes. In: A.W.D., Larkum, A.J. McComb, & S.A. Shepherd. Eds. Sea-grasses: with special reference to the Australasian region. Elsevier, North Holland, Amsterdam, pp. 458-499.
Borowitzka, M.A., P.S. Lavery, & M. van Keulen. 2006. Epiphytes of seagrasses. In: A. Larkum, R.J. Orth, & C. Duarte. Eds. Seagrasses: biology, ecology and conservation. Springer, Netherlands, pp. 441-461.
Bretos, M. & R.H. Chihuailaf. 1990. Biometría y otros aspectos biológicos de Fissurella pulchra (Mollusca: Prosobranchia). Biología Marina 25: 1-14.
Budzałek, G., S. Śliwińska-Wilczewska, K. Wiśniewska, A. Wochna, I. Bubak, A. Latała, & J.M. Wiktor. 2021. Macroalgal defense against competitors and herbivores. International Journal of Molecular Sciences 22: 7865. https://doi.org/10.3390/ijms22157865.
Connelly, P.W. & R.L. Turner. 2009. Epibionts of the Eastern surf chiton, Ceratozona squalida (Polyplacophora: Mopaliidae), from the Atlantic coast of Florida. Bulletin of Marine Science 85: 187-202.
Corado-Nava, N.A., D. Rodríguez & G. Rivas. 2014. Efecto de la colonización de los céspedes algales en el crecimiento de Pocillopora capitata (Anthozoa: Scleractinia) en el Pacífico tropical mexicano. Revista Mexicana de Biodiversidad 85: 1086-1092. https://doi.org/10.7550/rmb.43323.
Creed, J.C. 2000. Epibiosis on cerith shells in a seagrass bed: correlation of shell occupant with epizoite distribution and abundance. Marine Biology 137: 775-782.
Domènech, F., F.J. Badillo, J. Tomás, J.A. Raga, & F.J. Aznar. 2015. Epibiont communities of loggerhead marine turtles (Caretta caretta) in the western Mediterranean: influence of geographic and ecological factors. Journal of the Marine Biological Association of the United Kingdom 95: 851-861. https://doi.org/10.1017/S0025315414001520.
Donovan, D.A., B.L. Bingham, M. From, A.F. Fleisch, & E.S. Loomis. 2003. Effects of barnacle encrustation on the swimming behaviour, energetics, morphometry, and drag coefficient of the scallop Chlamys hastata. Journal of the Marine Biological Association of the United Kingdom 83: 813-819. https://doi.org/10.1017/S0025315403007847h.
Fuller, W.J., A.C. Broderick, R. Enever, P. Thorne, & B.J. Godley. 2010. Motile homes: a comparison of the spatial distribution of epibiont communities on Mediterranean sea turtles. Journal of Natural History, 44: 1743-1753. https://doi.org/10.1080/00222931003624820.
Gastaldi, M., F.N. Firstater, P. Daleo, & M.A. Narvarte. 2015. Abundance of the sponge Hymeniacidon cf. perlevis in a stressful environment of Patagonia: relationships with Ulva lactuca and physical variables. Journal of the Marine Biological Association of the United Kingdom 96: 465-472. https://doi.org/10.1017/S002531541500119.
Gómez-Cubillos, C., C. Gómez-Cubillos, A. Sanjuan-Muñoz & S. Zea. 2019. Interacciones de corales masivos con céspedes algales y otros organismos en arrecifes del Parque Nacional Natural Tayrona. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 48:143-171. https://doi.org/10.25268/bimc.invemar.2019.48.2.770.
Granhag, L.M., J.A. Finlay, P.R. Jonsson, J.A. Callow, & M.E. Callow. 2004. Roughness-dependent removal of settled spores of the green alga Ulva (syn. Enteromorpha) exposed to hydrodynamic forces from a water jet. Biofouling 20: 117-122. https://doi.org/10.1080/08927010410001715482.
Harder, T. 2009. Marine epibiosis: Concepts, ecological consequences, and host defense. In: J. W. Costerton. Eds. Marine and industrial biofouling. Berlin: Springer-Verlag, pp. 219-231. https://doi.org/10.1007/978-3-540-69796-1_12.
Haro, D.P. 2009. Identificación individual de ballenas jorobadas Megaptera novaeangliae (Borowski, 1781) en el golfo Corcovado, Patagonia norte, Chile: 2003-2009. Tesis de Maestría. Universidad Austral de Chile. 92 pp.
Lara-Uc, M.M. & C. Mota-Rodríguez. 2014. Las tortugas marinas cargando un mundo: flora y fauna epibionte. Bioagrociencias 7: 21-28.
Levenets, I.R., I.I. Ovsyannikova, & E.B. Lebedev. 2010. Epibiotic macroalgae on the scallop Mizuhopecten yessoensis in Peter the Great Bay, Sea of Japan. Russian Journal of Marine Biology 36: 340-349. https://doi.org/10.1134/S1063074010050032.
McCook, L.J. 1996. Effects of herbivores and water quality on Sargassum distribution on the Central Great Barrier Reef: cross shelf transplants. Marine Ecology Progress Series 139: 179-92. https://doi.org/10.3354/meps139179.
Madkour, F.F., W.S. Sallam, & M.K. Wicksten. 2012. Epibiota of the spider crab Schizophrys dahlak (Brachyura: Majidae) from the Suez Canal with special reference to epizoic diatoms. Marine Biodiversity Records 5: e64. https://doi.org/10.1017/S1755267212000437.
Manning, L.M. & N. Lindquist. 2003. Helpful habitant or pernicious passenger: interactions between an infaunal bivalve, an epifaunal hydroid and three potential predators. Oecologia 134 : 415-422. https://doi.org/10.1007/s00442- 002-1134-y.
McAllen, R. & Scott, G.W. 2000. Behavioral effects of biofouling in a marine copepod. Journal of Marine Biology Association United Kingdom 80: 379-380. https://doi.org/10.1017/S0025315499002003.
Montañés, M.A., J. Reyes & M. Sansón. 2003. La comunidad de epífitos de Zonaria tournefortii en el norte de Tenerife (Islas Canarias): análisis florístico y comentarios sobre su epifauna. Vieraea 31: 121-132.
Nava-Olvera, R., L.E. Mateo-Cid, A.C. Mendoza-González & D. García-López. 2017. Macroalgas, microalgas y cianobacterias epífitas del pasto marino Thalassia testudinum (Tracheophyta: Alismatales) en Veracruz y Quintana Roo, Atlántico mexicano. Revista de Biología Marina y Oceanografía 1552: 429-439. http://dx.doi.org/10.4067/S0718-19572017000300002.
Ortuño-Aguirre, C. & R. Riosmena-Rodríguez. 2007. Dinámica en el epifitísmo de Padina concrescens (Dictyotales, Phaeophyta) en el sureste de la Península de Baja California, México. Ciencias Marinas 33: 311-317.
Passarelli, C., F. Olivier, D.M. Paterson, T. Meziane, & C. Hubas. 2014. Organisms as cooperative ecosystem engineers in intertidal flats. Journal of Sea Research 92: 92-101. https://doi.org/10.1016/j.seares.2013.07.010.
Penhale, P.A. & W.O. Smith. 1977. Excretion of dissolved organic carbon by eelgrass (Zostera marina) and epiphytes. Limnology and Oceanography 22: 400-407. https://doi. org/10.4319/lo.1977.22.3.0400.
Pfaller, J.B., K.A. Bjorndal, K.J. Reich, K.L. Williams, & M.G. Frick. 2008. Distribution patterns of epibionts on the carapace of loggerhead turtles, Caretta caretta. Marine Biodiversity Records 1: e36. https://doi.org/10.1017/S1755267206003812.
Quiroz-González, N., L.G. Aguilar-Estrada, I. Ruiz-Boijseauneau & D. Rodríguez. 2020. Biodiversidad de algas epizoicas en el Pacífico tropical mexicano. Acta Botanica Mexicana 127: e1645. https://doi.org/10.21829/abm127.2020.1645.
Quiroz-González, N., L. Aguilar-Estrada, J. Acosta-Calderón, L. Álvarez-Castillo, & F. Arriola-Álvarez. 2023. Biodiversity of epiphytic marine macroalgae in Mexico: composition and current status. Botanica Marina 66: 181-189. https://doi.org/10.1515/bot-2023-0009.
Saunders, J.E., M.J. Attrill, S.M. Shaw, & A.A. Rowden. 2003. Spatial variability in the epiphytic algal assemblages of Zostera marina seagrass beds. Marine Ecology Progress Series 249: 107-115. https://doi.org/10.1016/j.aquabot.2005.02.003.
Sentíes, A., J. Espinoza-Ávalos, & J. Zurita. 1999. Epizoic algae of nesting sea turtles Caretta caretta and Chelonia mydas from the Mexican Caribbean. Bulletin of Marine Science 64: 185-189.
Vasconcelos, P., J. Cúrdia, M. Castro, & M.B. Gaspar. 2007. The shell of Hexaplex (Trunculariopsis) trunculus (Gastropoda: Muricidae) as a mobile hard substratum for epibiotic polychaetes (Annelida: Polychaeta) in the Ria Formosa (Algarve coast – southern Portugal). Hydrobiologia 575:161-172.
Vázquez-Texocotitla, P. 2013. Variación espacio-temporal de la estructura de los ensambles asociados a diferentes sustratos en el arrecife coralino El Zacatoso, Zihuatanejo, Guerrero. Tesis de maestría, Universidad Nacional Autónoma de México. 121 pp.
Wahl, M. 1989. Marine epibiosis. I. Fouling and antifouling: some basic aspects. Marine Ecology Progress Series 58: 175-189.
Wahl, M. 2008. Ecological lever and interface ecology: epibiosis modulates the interactions between host and environment. Biofouling 24: 427-438. https://doi.org/10.1080/08927010802339772.
Wahl, M. 2009. Epibiosis: ecology, effects and defense. In: S. Dürr, & J. C. Thomason. Eds. Marine hard bottom communities. Springer-Verlag, Heidelberg, Germany, pp. 61-72.
Wahl, M. 2010. Epibiosis. In: S. Dürr, & J.C. Thomason. Eds. Biofouling. Wiley-Blackwell, New Delhi, India, pp. 100-108.
Wernberg, T., F. Tuya, M. Thomsen, & G. Kendrick. 2010. Turban snails as habitat for foliose algae: contrasting geographical patterns in species richness. Marine Freshwater Research 61: 1237-1242. https://doi.org/10.1071/MF09184.
Sometido: 5 de febrero de 2024
Revisado: 7 de septiembre de 2024 (2 revisores anónimos)
Corregido: 28 de octubre de 2024
Aceptado: 29 de octubre de 2024